美国食品和药物管理局(FDA)于1月6日加速批准了阿尔茨海默病新药lecanemab(仑卡奈单抗)。这是渤健及其日本合作伙伴卫材在不到两年的时间里第二种获得早期批准的药物。
FDA的批准是在11月发表的临床试验结果表明,lecanemab在一定程度上减缓了因阿尔茨海默病而轻度受损的患者的认知能力下降之后,但这种治疗也有脑肿胀和出血的风险。
主导lecanemab开发的卫材公司在美国的定价为每年26500美元。该药物将以Leqembi的名称销售。
如果一种药物有望比现有药物更有效地帮助患有严重疾病的患者,FDA可以加快批准一种药物,以便迅速将其推向市场。2022年7月,渤健和卫材正式申请了加速审批。
FDA神经科学部门主任比利·邓恩博士在一份声明中说:
阿尔茨海默病会极大削弱患者的生活能力,并对他们的亲人产生毁灭性的影响。
这种治疗方案是针对影响阿尔茨海默病潜在疾病过程的最新疗法,而不仅仅是治疗疾病的症状。
新药疗效:适度延缓疾病
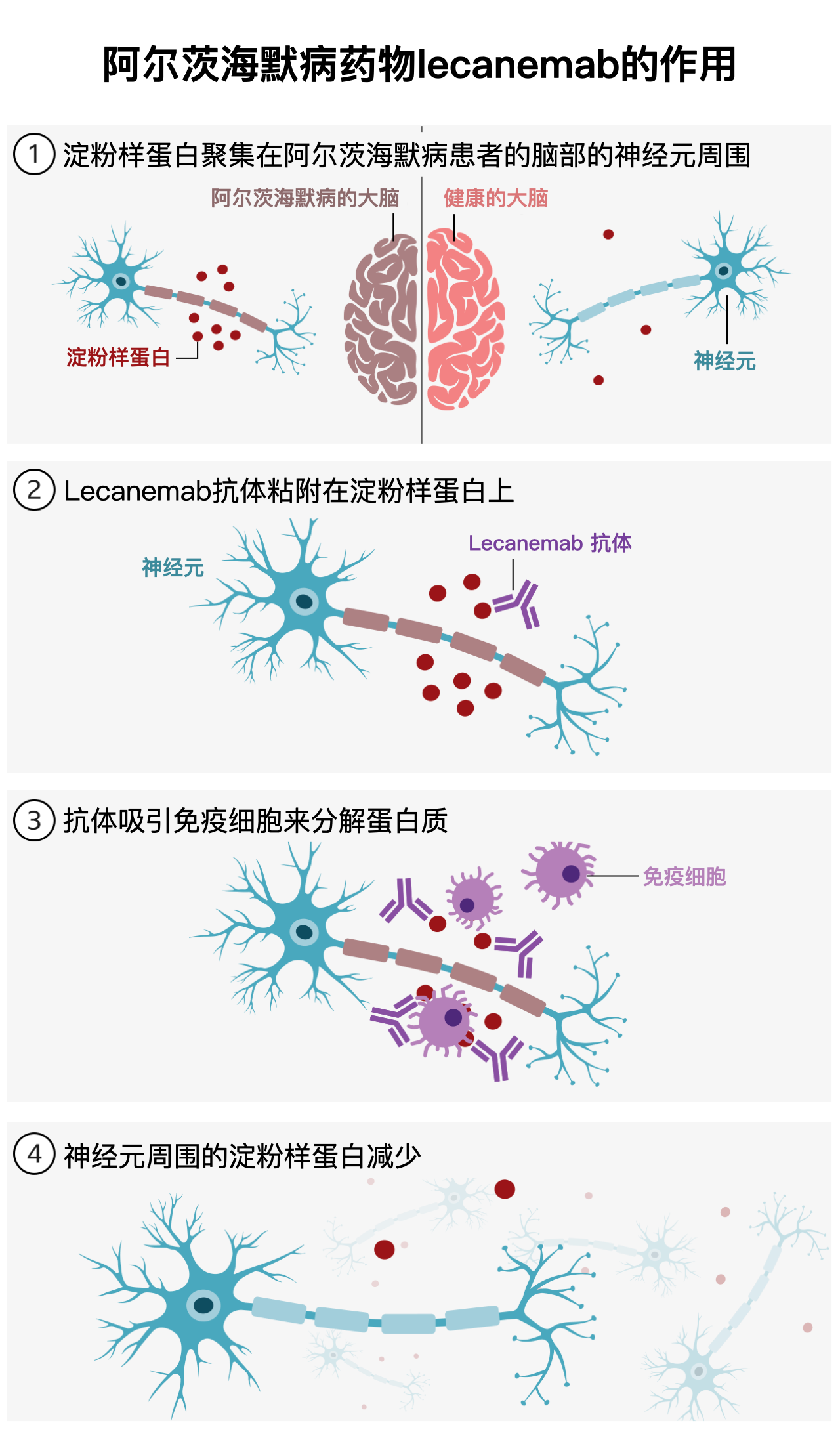
Lecanemab是一种单克隆抗体,靶向阿尔茨海默病患者大脑中积聚的淀粉样蛋白。这种抗体每两周静脉注射一次,剂量由患者体重决定,每公斤注射10毫克。
FDA在声明中表示,基于在接受该治疗的临床试验参与者中观察到的淀粉样斑块减少,FDA批准了lecanemab。没有接受治疗的参与者,淀粉样斑块没有减少。
发表在《新英格兰医学杂志》(New England Journal of Medicine)上的临床试验结果发现,在18个月的时间里,接受lecanemab治疗的患者的认知能力下降速度比未接受该治疗的患者慢27%。这项研究由渤健和卫材资助。
认知能力下降是用一种叫做临床痴呆评分的系统来衡量的,它是一个18分制的量表,得分越高表明受损程度越高。它衡量的是诸如记忆、判断和解决问题等认知功能。
阿尔茨海默病在接受lecanemab治疗的组中平均恶化1.21分,而未接受该治疗的组中平均恶化1.66分,差异为0.45分。
近1800名年龄在50至90岁之间的早期阿尔茨海默病患者参与了这项试验,其中约一半人接受了lecanemab治疗,另一半人没有接受。
新药的安全问题
尽管lecanemab可能在一定程度上减缓认知能力下降,但这种治疗也存在风险。
接受lecanemab治疗的患者中,有近13%出现脑肿胀,而未接受该治疗的患者中约有2%出现脑肿胀。然而,这些病例大多是轻中度,并没有引起症状,而且通常在四个月内解决。
接受lecanemab治疗的患者中,约3%的患者出现了更严重的脑肿胀,症状包括头痛、视觉障碍和思维混乱。
接受lecanemab治疗的患者中,约17%出现脑出血,而未接受该治疗的患者中这一比例为9%。与出血相关的最常见症状是头晕。
总体而言,在临床试验中,接受lecanemab治疗的患者中有14%发生严重不良事件,而未接受该治疗的患者中有11.3%发生严重不良事件。
该研究的作者说,需要更长的临床试验来确定lecanemab对早期阿尔茨海默病患者的疗效和安全性。
FDA表示,lecanemab的处方信息将包括有关肿胀和出血风险的警告,这被称为淀粉样蛋白相关成像异常(ARIA)。
2022年12月22日卫材宣布,由卫材和渤健共同开发的仑卡奈单抗注射液在中国提交的上市申请获得了中国药监局审评中心的受理,其适应症为轻度阿尔茨海默病和阿尔茨海默病引起的轻度认知障碍(MCI)的改善治疗。

参考资料:
https://www.cnbc.com/2023/01/06/alzheimers-disease-fda-decision-on-biogen-eisai-treatment-lecanemab.html
https://k.sina.com.cn/article_5895622040_15f680d9802001f453.html?from=health

