YY 0315—2023《钛及钛合金牙种植体》等13项医疗器械行业标准及7项医疗器械行业标准修改单已经审定通过,现予以公布。标准编号、名称、适用范围、修改单内容及实施日期见附件。
特此公告。
附件:1.医疗器械行业标准信息表
2.YY/T 0951—2015《干扰电治疗设备》医疗器械行业标准第1号修改单
3.YY/T 0919—2014《无源外科植入物 关节置换植入物 膝关节置换植入物的专用要求》医疗器械行业标准第1号修改单
4.YY/T 0966—2014《外科植入物 金属材料 纯钽》 医疗器械行业标准第1号修改单
5.YY/T 1426.1—2016《外科植入物 全膝关节假体的磨损 第1部分:载荷控制的磨损试验机的载荷和位移参数及相关的试验环境条件》医疗器械行业标准第1号修改单
6.YY/T 1426.2—2016《外科植入物 全膝关节假体的磨损 第2部分:测量方法》医疗器械行业标准第1号修改单
7.YY/T 1426.3—2017《外科植入物 全膝关节假体的磨损 第3部分:位移控制的磨损试验机的载荷和位移参数及相关的试验环境条件》医疗器械行业标准第1号修改单
8.YY/T 1447—2016《外科植入物 植入材料磷灰石形成能力的体外评估》医疗器械行业标准第1号修改单
国家药监局
2023年11月22日
附件1
医疗器械行业标准信息表
| 序号 | 标准编号 | 标准名称 | 制修订 | 替代标准 | 适用范围 | 实施日期 |
| 1 | YY 0315—2023 | 钛及钛合金牙种植体 | 修订 | YY 0315—2016 | 本文件规定了以锻制钛及钛合金材料制成的不带表面涂层的牙种植体的性能要求、包装、标识和使用说明书,并描述了相应的试验方法。本文件适用于由化学成分符合GB/T 13810或ISO 5832-2、ISO 5832-3、ISO 5832-11或ASTM F67、ASTM F136、ASTM F1295、ASTM F1472中外科植入物用钛及钛合金材料制成的牙种植体。本文件不适用于牙种植体附件和增材制造钛及钛合金牙种植体。 | 2026年12月1日 |
| 2 | YY 0469—2023 | 医用外科口罩 | 修订 | YY 0469—2011 | 本文件规定了医用外科口罩的技术要求、试验方法、标志、包装、运输和贮存。本文件适用于医护人员在含有潜在血液、体液、分泌物污染风险的医疗环境及有创操作环境佩戴的一次性医用口罩。本文件不适用于医用及其它工作环境下的防护口罩。 | 2026年12月1日 |
| 3 | YY 0793.2—2023 | 血液透析和相关治疗用液体的制备和质量管理 第2部分:血液透析和相关治疗用水 | 修订 | YY 0572—2015 | 本文件规定了制备透析浓缩液、透析用液体(用于血液透析、血液透析滤过或血液滤过)所用水的最低要求。本文件适用于制备透析浓缩液、透析用液体(用于血液透析、血液透析滤过或血液滤过)所用水。本文件不涉及水处理设备的使用,及水经处理后与浓缩物混合制成最终透析液的操作。这些操作由透析专业人员负责。本文件不适用于透析液再生系统。 | 2026年12月1日 |
| 4 | YY 1042—2023 | 牙科学 聚合物基修复材料 | 修订 | YY 1042—2011 | 本文件规定了牙科聚合物基修复材料的要求。该类材料是以适合于经机械混合、手工调和、或在口腔内和口腔外采用外部能量激活的形式提供的,主要用于牙齿的直接或间接修复和粘固。本文件所涵盖的聚合物基粘固材料是指用于修复体和修复装置,如嵌体、高嵌体、贴面、冠和桥的粘固或固位的材料。本文件不涵盖材料中含有粘接性成分的聚合物基粘固材料(见ISO/TS 16506)。本文件不涵盖用于预防龋齿的牙科聚合物基材料(见YY 0622)、桩核材料或用于金属基底上的贴面材料(见YY 0710)。 | 2026年12月1日 |
| 5 | YY/T 0003—2023 | 手动病床 | 修订 | YY/T 0003—1990 | 本文件规定了手动病床的要求、试验方法和说明书。本文件适用于手动病床。该产品预期用于身高等于或大于146cm,质量等于或大于40kg,体重指数(BMI)等于或大于17的患者。 | 2025年12月1日 |
| 6 | YY/T 0127.4—2023 | 口腔医疗器械生物学评价 第4部分:骨植入试验 | 修订 | YY/T 0127.4—2009 | 本文件描述了口腔医疗器械的骨植入试验方法。本文件适用于评价组织对拟长期或持久与口腔骨组织接触的口腔医疗器械的生物学反应。 | 2024年12月1日 |
| 7 | YY/T 0127.19—2023 | 口腔医疗器械生物学评价 第19部分:亚急性和亚慢性全身毒性试验:植入途径 | 制定 | / | 本文件描述了口腔医疗器械亚急性和亚慢性植入途径的全身毒性试验方法。本文件适用于评价口腔医疗器械植入途径的亚急性和亚慢性全身毒性试验。 | 2024年12月1日 |
| 8 | YY/T 0489—2023 | 一次性使用无菌引流导管及辅助器械 | 修订 | YY/T 0489—2004 | 本文件规定了一次性使用无菌的引流导管、伤口和积液引流系统、手术引流导管和有关组件的要求,其中导管以手术或经皮方式放置于体腔或伤口中,用于将液体或空气引流到体外。引流导管留作自然引流或连接至吸引源(以加快组织肉芽形成)。本文件不适用于:抽吸导管;气管导管;导尿管;输尿管支架、胆道支架和其他支架;采用胃造口术经皮置入消化道的引流管;用于去除脑脊液的轴索导管;用于从胃肠道中去除溶液或物质的肠导管;涂层。 | 2024年12月1日 |
| 9 | YY/T 0929.3—2023 | 输液用药液过滤器 第3部分:标称孔径0.22μm药液过滤器液体细菌截留试验方法 | 修订 | YY/T 0918—2014 | 本文件描述了评价标称孔径0.22 μm输液用药液过滤器液体细菌截留能力的试验方法。本文件适用于标称孔径0.22 μm输液用药液过滤器液体细菌截留能力的评价,输液用药液过滤膜材液体细菌截留能力的评价可参考本文件。本文件不适用于0.22 μm输液用药液过滤器对特定种类药品细菌截留能力的验证。该验证宜采用特定药液或替代溶液在模拟实际临床输液条件下进行。 | 2024年12月1日 |
| 10 | YY/T 0969—2023 | 一次性使用医用口罩 | 修订 | YY/T 0969—2013 | 本文件规定了一次性使用医用口罩的技术要求、试验方法、标志、包装、运输和贮存。本文件适用于覆盖使用者口、鼻及下颌,用于普通医疗环境中佩戴、阻隔口腔和鼻腔呼出或喷出污染物的一次性使用口罩。本文件不适用于医用防护口罩、医用外科口罩。 | 2025年12月1日 |
| 11 | YY/T 1842.3—2023 | 医疗器械 医用贮液容器输送系统用连接件 第3部分:胃肠道应用 | 制定 | / | 本文件规定了预期用于胃肠道贮液容器连接件的尺寸及设计与功能特性的要求。本文件未规定使用这些连接件的医疗器械或附件的尺寸或性能要求。这些要求在专用的医疗器械或附件的标准中给出。本文件不适用于螺纹盖、皇冠盖以及螺口,因为它们不是医疗器械专用的连接件。尽管胃肠道给养器经常需要与其连接,但他们更适用于食品和饮料包装的领域。 | 2024年12月1日 |
| 12 | YY/T 1904—2023 | 医用防护眼(面)罩 | 制定 | / | 本文件规定了医用防护眼罩和医用防护面罩的要求、试验方法、标志、包装、运输和贮存。本文件适用于在医疗工作环境下佩戴,防止患者血液、体液、分泌物等直接溅入眼、面部引起感染的一次性使用的医用防护眼罩、医用隔离眼罩(以下简称眼罩)和医用防护面罩、医用隔离面罩(以下简称面罩)。本文件不适用于非医用及其他医疗用途的眼罩和面罩。 | 2025年12月1日 |
| 13 | YY/T 1928—2023 | 预期用于磁共振环境的医用电气设备的术语和分类 | 制定 | / | 本文件界定了预期用于磁共振环境的医用电气设备的术语,规定了预期用于磁共振环境的医用电器设备的分类。本文件适用于在磁共振环境中使用的医用电气设备。 | 2024年12月1日 |
附件2
YY/T 0951—2015《干扰电治疗设备》
医疗器械行业标准第1号修改单
(与YY 9706.210—2021同步实施)
一、第2章中
1.“GB 9706.1—2007 医用电气设备 第1部分:安全通用要求”
修改为:
“GB 9706.1—2020 医用电气设备 第1部分:基本安全和基本性能的通用要求”
2.“YY 0505 医用电气设备 第1-2部分:安全通用要求 并列标准:电磁兼容 要求和试验”
修改为:
“YY 9706.102 医用电气设备 第1-2部分:基本安全和基本性能的通用要求 并列标准:电磁兼容 要求和试验”
3.“YY 0607—2007 医用电气设备 第2部分:神经和肌肉刺激器安全专用要求”
修改为:
“YY 9706.210—2021 医用电气设备 第2-10部分:神经和肌肉刺激器的基本安全和基本性能专用要求”
4.“YY 0868—2011 神经和肌肉刺激器用电极”
修改为:
“YY/T 0868—2021 神经和肌肉刺激器用电极”
二、5.16.2中
1.“用测量时间T替代YY 0607—2007中5s的要求”
修改为:
“用测量时间T替代YY 9706.210—2021的201.7.2.101中1s的要求”
2.“用输出电流(r.m.s)替代50.101中的输出幅度”
修改为:
“用输出电流(r.m.s)替代YY 9706.210—2021的201.12.4.101中的输出幅度”
三、6.3输出电流中
1.“T为5s或动态节律”
修改为:
“T为1s或动态节律”
2.删除“注:测量时间T替代YY 0607—2007中5s的要求。”
附件3
YY/T 0919—2014《无源外科植入物 关节置换植入物 膝关节置换植入物的专用要求》
医疗器械行业标准第1号修改单
(自发布之日起实施)
一、第2章中
增加:
“YY/T 0924.2 外科植入物 部分和全膝关节假体部件 第2部分:金属、陶瓷及塑料关节面(YY/T 0924.2—2014,ISO 7207-2:2011,IDT)”
二、第5章中
增加:
“5.4 膝关节部件关节面的表面粗糙度
YY/T 0924.2规定了超高分子量聚乙烯、金属和陶瓷关节面的表面粗糙度要求。”
附件4
YY/T 0966—2014《外科植入物 金属材料
纯钽》医疗器械行业标准第1号修改单
(自发布之日起实施)
一、封面
“(ISO 13782:1996,IDT)”
修改为:
“(ISO 13782:2019,IDT)”
二、前言
“本标准使用翻译法等同采用ISO 13782:1996《外科植入物 金属材料 纯钽》(英文版)”
修改为:
“本标准使用翻译法等同采用ISO 13782:2019《外科植入物 金属材料 纯钽》”
三、第2章中
“ISO 6892-1:2009 金属材料 拉伸试验 第1部分:室温试验方法(Metallic materials — Tensile testing — Part 1: Method of test at room temperature)”
修改为:
“ISO 6892-1 金属材料 拉伸试验 第1部分:室温试验方法(Metallic materials — Tensile testing — Part 1: Method of test at room temperature)”
四、表2中
板材和带材冷加工力学性能由
| 形式 | 状态 | 厚度或直径d/mm | 抗拉强度Rm/MPa | 规定非比例延伸强度Rp0.2/MPa | 断后伸长率A/(%) |
| 板材和带材 | 冷加工 | 0.13≤d≤0.26 | ≥520 | ≥345 | —— |
| >0.26 | ≥2 |
修改为:
| 形式 | 状态 | 厚度或直径d/mm | 抗拉强度Rm/MPa | 规定非比例延伸强度Rp0.2/MPa | 断后伸长率A/(%) |
| 板材和带材 | 冷加工 | ≥0.13 | ≥520 | ≥345 | ≥2 |
五、第五章中
增加:
“如果有任何试验样品不符合要求并且标距范围内失效,对于每件失效样品可另取出两件试样用同样的方法进行试验。只有这两件试样都符合规定的要求,才认为是合格的。
如果试验样品在标距范围外失效,若断后伸长率符合要求则该测试有效;若断后伸长率不符合要求,则应放弃该测试并重新进行试验。
如果有任何重新试验结果不符合要求,则其所代表的产品应判定为不符合本文件。如需要,供应商可以对材料进行再次热处理,重新按照本文件进行测试。”
附件5
YY/T 1426.1—2016《外科植入物 全膝关节
假体的磨损 第1部分:载荷控制的磨损试验机的载荷和位移参数及相关的试验环境条件》
医疗器械行业标准第1号修改单
(自发布之日起实施)
一、3.3中
“轴向力 axis force
施加于膝关节假体胫骨部件的平行于胫骨轴线的力。
注:当力的作用方向由下向上时规定该力为正(见图1和图2)”
修改为:
“轴向力 axial force
施加于膝关节假体胫骨部件或股骨部件垂直于横断面的力。
注:当力施加于胫骨部件时,将轴向力由下向上规定为正(见图1
和图2);当力施加于股骨部件时,将轴向力由上向下规定为正”
二、图1
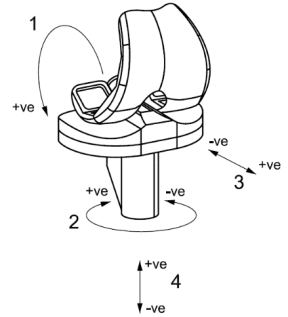

说明:
1——屈曲(股骨部件);
2——胫骨旋转,胫骨旋转扭矩;
3——胫骨部件的前后位移,作用在胫骨部件的前后力;
4——轴向力。
图1 全膝关节置换系统左膝的力、扭矩和运动的符号规定
修改为:
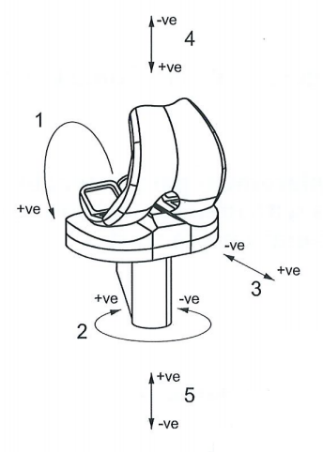
标引序号说明:
1——屈曲(股骨部件);
2——胫骨旋转;
3——胫骨部件的前后位移;
4——当轴向力施加于股骨部件时的极性;
5——当轴向力施加于胫骨部件时的极性。
图1 全膝关节置换系统左膝的力和运动符号的规定
附件6
YY/T 1426.2—2016《外科植入物 全膝关节假体的磨损 第2部分:测量方法》医疗器械行业标准第1号修改单
(自发布之日起实施)
一、封面
“(ISO 14243-2:2009,IDT)”
修改为:
“(ISO 14243-2:2016,MOD)”
二、前言
“本部分使用翻译法等同采用ISO 14243-2:2009《外科植入物 全膝关节假体的磨损 第2部分:测量方法》
与本部分中规范性引用的国际文件有一致性对应关系的我国文件如下:
——YY/T 1426.1—2016 外科植入物 全膝关节假体的磨损 第1部分载荷控制的磨损试验机的载荷和位移参数及相关的试验环境条件(ISO 14243-1:2009,IDT)。”
修改为:
“本部分修改采用ISO 14243-2:2016《外科植人物 全膝关节假体的磨损 第2部分:测量方法》
与ISO 14243-2:2016相比,主要技术变化如下:
——关于规范性引用文件,本文件做了具有技术性差异的调整,以适应我国的技术条件,提高可操作性,具体调整如下:
• 用等同采用国际标准的YY/T 1426.1代替了ISO 14243-1;
•用等同采用国际标准的YY/T 1426.3代替了ISO 14243-3。”
三、第1章中
“YY/T 1426的本部分规定了按第1部分进行全膝关节假体磨损试验后利用重量分析法评估全膝关节假体胫骨部件磨损的方法。”
修改为:
“YY/T 1426的本部分规定了按第1部分或第3部分进行全膝关节假体磨损试验后利用重量分析法评估全膝关节假体胫骨部件磨损的方法。”
四、第2章中
“ISO 14243-1 外科植入物 全膝关节假体的磨损 第1部分:载荷控制的磨损试验机的载荷和位移参数及相关的试验环境条件(Implants for surgery — Wear of total knee-joint prostheses — Part 1: Loading and displacement parameters for wear-testing machines with load control and corresponding environmental conditions for tests)”
修改为:
“YY/T 1426.1外科植入物 全膝关节假体的磨损 第1部分:载荷控制的磨损试验机的载荷和位移参数及相关的试验环境条件(YY/T 1426.1—2016及1号修改单,ISO 14243-1: 2009&AMD 1:2020,IDT)”
增加:
“YY/T 1426.3 外科植入物 全膝关节假体的磨损 第3部分:位移控制的磨损试验机的载荷和位移参数及相关的试验环境条件(YY/T 1426.3—2017及1号修改单,ISO/ 14243- 3:2014&AMD 1:2020,IDT)”
五、4.2.1中
“液体试验介质,按ISO 14243-1规定。”
修改为:
“液体试验介质,视情况按YY/T 1426.1或YY/T 1426.3的规定。”
六、4.2.2
删除本条款。
七、4.4.1中
“试验样品,符合ISO 14243-1。”
修改为:
“试验样品,符合YY/T 1426.1或YY/T 1426.3。”
八、4.4.2中
“对照样品,符合ISO 14243-1。”
修改为:
“对照样品,符合YY/T 1426.1或YY/T 1426.3。”
九、4.6.1中
“在试验机上安装样品,并根据ISO 14243-1进行磨损试验。”
修改为:
“在试验机上安装样品,并按照YY/T 1426.1或YY/T 1426.3进行磨损试验。”
十、第5章中
“ f)引用ISO 14243-1规定的磨损试验方法;”
修改为:
“ f)引用YY/T 1426.1或YY/T 1426.3规定的磨损试验方法;”
附件7
YY/T 1426.3—2017《外科植入物 全膝关节假体的磨损 第3部分:位移控制的磨损试验机的载荷和位移参数及相关的试验环境条件》医疗器械行业标准第1号修改单
(自发布之日起实施)
一、3.3中
“轴向力 axis force
膝关节假体胫骨部件沿平行于胫骨轴线方向施加于股骨部件的力。
注:当力的作用方向由下向上时规定定义为正(见图1和图2)”
修改为:
“轴向力 axial force
施加于膝关节假体胫骨部件或股骨部件垂直于横断面的力。
注:当力施加于胫骨部件时,将轴向力由下向上规定为正(见图1
和图2);当力施加于股骨部件时,将轴向力由上向下规定为正”
二、图1

说明:
1——屈曲(股骨部件);
2——胫骨旋转;
3——胫骨部件前后位移;
4——轴向力。
图1 全膝关节置换系统左膝的力和运动的符号法则
修改为:

标引序号说明:
1——屈曲(股骨部件);
2——胫骨旋转;
3——胫骨部件的前后位移;
4——当轴向力施加于股骨部件时的极性;
5——当轴向力施加于胫骨部件时的极性。
图1 全膝关节置换系统左膝的力和运动符号的规定
附件8
YY/T 1447—2016《外科植入物 植入材料
磷灰石形成能力的体外评估》医疗器械
行业标准第1号修改单
(自发布之日起实施)
一、封面
“(ISO 23317:2012,IDT)”
修改为:
“(ISO 23317:2014,IDT)”
二、前言
“本标准使用翻译法等同采用ISO 23317:2012《外科植入物 植入材料磷灰石形成能力的体外评估》。”
修改为:
“本标准使用翻译法等同采用ISO 23317:2014《外科植入物 植入材料磷灰石形成能力的体外评估》。”
三、7.3中:
“在极少数情况下,磷灰石既会在SBF溶液中均匀析出,也会沉积在样品表面。”
修改为:
“纯净、新鲜制备、无尘的SBF溶液在透明瓶中加热至37℃持续4周,即使没有任何测试样品浸入其中,溶液仍会析出磷灰石。如果碰巧有一个试样浸入该溶液中,那么将会有溶液析出物沉积在试样的表面。”

