COVID-19住院患者中常见神经系统并发症。80%以上的住院患者可能在病程中出现神经系统症状。
发生率随地理区域和患者特征不同而不同。最常见的可能是肌痛、头痛、脑病和头晕,在中国、欧洲和美国患者中的发生率约为1/3。
味觉障碍、嗅觉丧失等神经系统症状可能较少见,但在重度认知或心肺功能障碍患者中可能不易准确确认症状。
脑卒中、运动障碍、运动和感觉障碍、共济失调和癫痫发作不常见。
危重症患者的神经系统并发症发生率高于较轻症患者。
由于接种疫苗和保持社交距离措施,COVID-19急性表现的发生率和严重程度均下降,一些患者报告了持续性神经系统症状,如认知功能障碍、头痛和麻木。
本文来自循证医学知识库UpToDate临床顾问专题《COVID-19:神经系统并发症及神经系统疾病管理》,将总结COVID-19的神经系统并发症和出现COVID-19的神经系统疾病患者的管理。(本文超长,建议收藏)
总结与推荐
●COVID-19的神经系统表现
约半数住院COVID-19患者有神经系统表现。肌痛、头痛和脑病可能最常见。
脑病常见于COVID-19危重症患者,发生率为30%-55%。常见原因包括中毒性代谢性脑病、药物作用、脑血管疾病和非惊厥性癫痫发作。
1%-3%的COVID-19住院患者出现脑卒中,COVID-19病情越严重,则发生率越高。可见不同类型的脑卒中,包括缺血性脑卒中、颅内出血和脑静脉窦血栓形成。除传统脑卒中机制外,COVID-19相关缺血性脑卒中的潜在机制还包括高凝状态、炎症、肾素-血管紧张素-醛固酮系统功能障碍和心功能不全。
在COVID-19患者中有吉兰-巴雷综合征(GBS)及相关综合征的报道。一般而言,对此类患者的评估和治疗与非COVID-19患者的相似。
COVID-19的罕见神经系统表现包括脑膜脑炎、小脑炎、急性播散性脑脊髓炎、多系统炎症综合征、癫痫发作、全身性肌阵挛和可逆性后部白质脑病。
●COVID-19后持续性神经系统症状
一些患者报告COVID-19症状在急性感染后仍持续存在数周至数月。其他一些症状较轻、从不需要住院的急性COVID-19患者也可能持续存在神经系统和全身性症状。据报道,5%-80%的患者在急性COVID-19感染后≥4周仍持续存在相关症状。
●神经系统疾病患者的管理
接受免疫抑制治疗的神经系统疾病患者感染COVID-19的风险并未增加,在未感染时应继续接受这类药物治疗。
若接受这类药物治疗的患者感染了严重急性呼吸综合征冠状病毒2型(SARS-CoV-2),我们建议采取个体化方案,综合考虑特定药物的相关风险、基础神经系统疾病的严重程度和COVID-19病情的严重程度。
有心血管疾病(包括脑卒中)病史的患者感染COVID-19后的结局可能更差;其他存在严重影响日常活动能力的神经系统疾病的患者可能也如此。应特别建议这类患者坚持采取预防措施。
●神经系统疾病患者的疫苗接种
我们鼓励无禁忌证的患者在条件允许时尽快接种COVID-19疫苗,因为某些神经系统疾病患者感染COVID-19后出现重症的风险较高。
一、神经系统发病机制
COVID-19患者的神经系统并发症有多种潜在机制,一些病例中更是多因素致病。神经系统并发症最常由针对感染的全身性反应引起,包括如下不同机制:
(1)全身性功能障碍导致神经损伤
重度COVID-19患者中常见低氧血症,可能是许多脑病患者的致病因素;器官衰竭和药物作用导致的代谢紊乱也可能是脑病致病因素。中重度COVID-19患者血浆的神经化学证据包括星形细胞及神经元损伤,并未提示特定的发病机制。
对COVID-19死亡患者的神经病理学病例系列研究发现,几乎所有患者都存在急性缺氧缺血性损伤,还有许多存在出血性和单纯缺血性梗死、小胶质细胞活化伴小胶质细胞结节以及噬神经细胞现象。其他研究报道的神经影像学表现符合迟发性缺氧后白质脑病,并且与COVID-19无关急性呼吸窘迫综合征(ARDS)患者的表现相似。
(2)肾素-血管紧张素系统功能异常
肾素-血管紧张素系统(renin-angiotensin system, RAS)的活性异常也可能是COVID-19感染相关的病理生理机制。SARS-CoV-2利用膜结合蛋白血管紧张素转化酶2(angiotensin converting enzyme 2, ACE2)进入细胞。ACE2将血管紧张素Ⅱ转换为血管紧张素-(1-7),后者具有舒张血管、抗增殖及抗纤维化效应。SARS-CoV-2通过结合ACE2、抑制内皮细胞的线粒体功能和一氧化氮合成酶活性,可破坏血管内皮细胞,继而影响心脑血管。
(3)免疫紊乱
机体对SARS-CoV-2的全身性免疫应答失调可能是致病因素。
•促炎状态
COVID-19危重患者常出现重度全身炎症反应的征象,与细胞因子风暴综合征样表现相似,包括持续发热、炎症标志物升高(如D二聚体、铁蛋白)和促炎症细胞因子增加。重度COVID-19患者中,外周血TNF、TNF-α和IL-6等炎症标志物升高。
高水平的循环促炎症细胞因子可导致意识模糊和意识状态改变。一项病例系列研究报道了5例通气后延迟觉醒的COVID-19相关ARDS患者,其脑血管壁MRI检查显示颅底动脉血管壁异常对比增强,提示可能存在内皮炎。但这些影像学异常在皮质类固醇治疗后并未消失,且病理检查未见炎症。
促炎症状态也可能导致易栓症(“血栓性炎症”),增加了脑卒中及其他血栓事件的风险。重度COVID-19患者的补体激活也可造成血栓性微血管损伤。
细胞因子释放也可能通过激活小胶质细胞、引发全身性炎症反应而造成脑损伤。病例系列研究和病例报告,在无病毒直接入侵迹象的脑组织中发现了小胶质细胞结节和噬神经细胞现象。其他病毒感染中可见小胶质细胞活化并吞噬缺氧神经元。
•感染相关与感染后并发症
相对于COVID-19感染的初始症状,神经系统症状出现的时机提示,在大多数患者中,吉兰-巴雷综合征(Guillain-Barré syndrome, GBS)是感染相关并发症,而非感染后并发症。一例患者的肌无力先于发热和呼吸道症状出现。其他病例报告显示,病毒感染与肌无力发作之间的时间间隔较长,这符合感染后并发症。
(4)病毒直接侵犯神经系统
一些报道证实病毒直接侵犯神经系统。尸检病例系列研究在大部分脑组织标本中检出了SARS-CoV-2,但这些发现与神经病理表现的严重程度无关。这提示,神经损伤可能是由SARS-CoV-2触发的全身性炎症反应引起,而非由感染本身导致。
尚不确定SARS-CoV-2是否直接感染脑血管。尸检研究报道了SARS-CoV-2病毒直接侵犯内皮的潜在证据,可能导致肺、心脏、肾、肝及小肠出现相关的内皮炎。但这仍存在争议,因为电子显微镜观察到的肾血管内皮“病毒颗粒”可能实际上是正常结构或伪影。病例报告表明可能存在多灶性缺血和出血性病变,符合内皮损伤、微血栓形成或小血管炎,但未行病理检查。神经病理学研究尚未证实SARS-CoV-2可导致明确的脑血管炎。
二、嗅觉和味觉障碍
据报道,嗅觉丧失和味觉障碍是COVID-19常见的早期症状,一项研究中的发生率超过80%。一篇meta分析纳入了83项研究、27,000余例患者,显示48%存在嗅觉障碍(95%CI 41.2-54.5)。这可能是COVID-19的首发症状,可不伴鼻充血或流涕;但这极少是COVID-19的唯一临床表现。
据报道,COVID-19患者的MRI检查示一侧或双侧嗅球信号异常,影像学随访时消退。两例尸检的病理学结果显示嗅束出现炎性浸润和轴突损伤,但无法确定是否为病毒直接损伤所致。暂时性嗅觉丧失可能并非由嗅神经元直接损伤所致,而是与鼻上皮内的支持细胞发生炎性改变相关。一项对20例嗅觉丧失患者进行的MRI研究在鼻腔嗅裂部位发现了水肿性阻塞,1个月随访时,嗅觉功能与阻塞的改善情况相关。
目前缺乏关于疾病长期预后的可靠数据。一项研究显示,在33%已恢复嗅觉的受累患者中,平均症状持续时间为8日。意大利一项对非住院嗅觉障碍患者进行的调查发现,症状出现后平均37日时,83%的患者诉完全恢复。在接受客观嗅觉检测的51例嗅觉丧失患者中,4个月和8个月时分别有84%和96%完全恢复。一些患者在COVID-19感染急性期后,嗅觉丧失和味觉障碍可能伴随其他神经系统或全身性症状持续存在数月。
这些症状也可见于其他病毒感染及其他病因;评估方法详见其他专题。(参见 “成人味觉和嗅觉障碍的评估和治疗”)
三、脑病
危重症COVID-19患者常见脑病。一项队列研究纳入2088例入住ICU的COVID-19患者,谵妄常见,发生率为55%。一项有关509例COVID-19住院患者的研究显示,31.8%有脑病,且相比无脑病者具有以下特点:
年龄更大(66岁 vs 55岁)
从症状发作到住院的时间更短(6日 vs 7日)
更可能是男性
更可能有危险因素(包括神经系统疾病、癌症、脑血管病、慢性肾脏病、糖尿病、血脂异常、心力衰竭、高血压或吸烟等病史)
脑病可能是COVID-19的主要症状。一项研究纳入了817例在急诊科接受评估的COVID-19感染老年患者(中位年龄78岁),发现28%存在脑病。这些患者中37%没有典型的COVID-19症状,如发热或呼吸困难。脑病的危险因素包括老龄、视力损伤、帕金森病或脑卒中病史,以及既往使用精神活性药物。
(1)临床、实验室和影像学特征
COVID-19患者可能出现明显谵妄和需要镇静的激越;也可能发生脑病伴嗜睡和意识水平下降。反射亢进和伸性跖反射等皮质脊髓束征常见;也有COVID-19患者发生脑病伴癫痫发作的报道,就像在其他情况下的中毒性代谢性脑病中所见。这些症状和体征详见其他专题。
大多数情况下,脑病发生于危重症患者中;也有例外,患者早期便出现谵妄,甚至是起病特征。短暂性全面遗忘症也有报道。目前尚不清楚在不伴呼吸道症状或缺氧的情况下,COVID-19患者是否会出现长时间的意识模糊状态。
神经影像学检查或脑脊液(cerebrospinal fluid, CSF)分析中,脑病患者通常没有脑组织炎症证据,但也有另外。
●MRI表现
在COVID-19相关脑病患者中报道了一系列神经影像学异常,其中部分发现提示患者的精神状态为其他特定病症所致,如脑卒中、脑炎、可逆性后部白质脑病综合征(reversible posterior leukoencephalopathy syndrome, RPLS)等。
总体上,约半数COVID-19相关脑病患者的神经影像学检查显示急性病变,最常见的有急性缺血性脑卒中、皮层液体衰减反转恢复(fluid-attenuated inversion recovery, FLAIR)成像信号异常、柔脑膜强化(通常轻微)以及其他脑炎表现。
目前也在COVID-19相关脑病成人患者以及少数合并多系统炎症综合征的COVID-19患儿中,报道了胼胝体压部的细胞毒性病变。(参见 “COVID-19:儿童多系统炎症综合征(MIS-C)的临床特征、评估和诊断”)
●脑电图表现
COVID-19合并脑病患者的脑电图表现通常是非特异性的。
●脑脊液
脑脊液异常不具特异性,且只见于少数患者(包括有急性神经系统症状者)。脑脊液白细胞计数升高的患者应进一步评估是否存在脑炎或其他疾病。
(2)原因和危险因素
COVID-19患者脑病的病因往往是多因素的。COVID-19危重患者发生脑病的原因与其他危重患者相同。激越型或活动减退型谵妄的常见病因多样,包括中毒性代谢性脑病、药物作用、脑血管疾病、非惊厥性癫痫发作等,详见附表(表 1)。与入住ICU的COVID-19患者谵妄风险较高相关的因素包括:机械通气、使用血管加压药、使用约束措施、给予苯二氮卓类药物或持续输注阿片类药物,以及缺乏家属探视。这些原因见其他专题。(参见 “成人急性中毒性代谢性脑病”,关于‘具体病因’一节)
其他相对不常见的COVID-19并发症也可导致精神状态改变,包括缺血性或出血性脑卒中、脑炎、可逆性后部脑病综合征(posterior reversible encephalopathy syndrome, PRES)、多系统炎症综合征以及感染后脱髓鞘疾病。
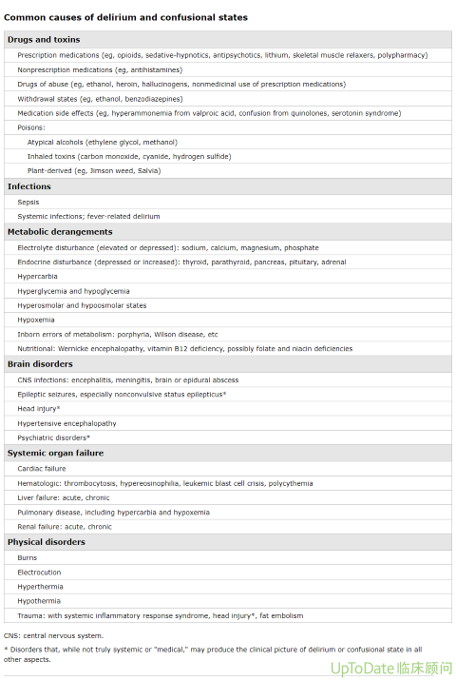
表1
(3)评估与处理
如果患者的持续性脑病无法用镇静药、低氧血症或其他全身性因素解释,可能需要进一步评估以排除其他病因。查体发现局灶性或偏侧性神经系统体征的患者应接受神经影像学检查。对其他患者是否行进一步检查取决于临床具体情况,可能包括MRI平扫和钆增强扫描、脑电图检查以排除亚临床癫痫发作,以及脑脊液取样分析以排除中枢神经系统感染。脑脊液白细胞计数升高的患者应进一步评估脑炎或其他疾病。脑病患者的评估详见其他专题。(参见 “谵妄和精神错乱的诊断”,关于‘评估’一节)
与其他原因导致的脑病一样,治疗主要是针对基础疾病,详见其他专题。(参见 “2019冠状病毒病(COVID-19):住院成人患者的处理”和 “2019冠状病毒病(COVID-19):插管成人的管理”)
COVID-19合并脑病患者的对症处理与其他伴谵妄的危重患者相同,见其他专题。(参见 “谵妄和急性精神错乱状态的预防、治疗和预后”,关于‘处理’一节和 “危重病成人患者中镇静-镇痛药物的选择、启用、维持和停用”)
COVID-19合并脑病患者的治疗中,糖皮质激素或其他免疫调节疗法的作用不明。但在有进一步研究数据帮助识别免疫治疗有效的患者之前,不应将糖皮质激素或其他免疫调节疗法视为COVID-19相关脑病患者的常规治疗选择。
糖皮质激素在COVID-19重症患者一般治疗中的作用详见其他专题。(参见 “2019冠状病毒病(COVID-19):住院成人患者的处理”,关于‘地塞米松和其他糖皮质激素’一节)
(4)预后
脑病是不良结局的危险因素。一项研究显示,合并脑病的COVID-19住院患者与无脑病的患者相比,住院时间更长、出院时功能损害更严重,且30日死亡率更高(22% vs 3%)。另一项研究中,MRI和脑脊液结果均正常的患者最有可能更早恢复。
与其他危重患者一样,神经功能障碍可能在急性病症状消退后才出现改善。我们的临床经验和一些已发表的报告表明,一些在重症COVID-19情况下出现长时间意识障碍的患者可能在停用镇静药后长达数日才清醒,并在之后恢复。与恢复用时较长相关的因素包括低氧血症、肌松/镇静药使用时长、年龄和男性。在后来恢复的COVID-19合并脑病患者中,约1/3在出院时仍存在主观认知障碍。因此,对于神经影像学检查没有发现结构性脑损伤的脑病患者,或没有其他证据显示生存无望的患者,医生应慎重考虑撤除生命支持措施。
四、脑血管疾病
(1)危险因素和机制
●脑卒中的传统危险因素
COVID-19相关缺血性脑卒中患者大多年龄较大、有血管危险因素,可见高血压、高脂血症、房颤和/或糖尿病等传统脑卒中危险因素。
●感染相关的高凝和促炎状态
虽然已推测了几种COVID-19相关脑卒中发病机制,但根据观察到的高凝和炎症标志物升高,与病毒或宿主免疫应答相关的易栓症可能是一个重要机制。
大量证据表明COVID-19与高凝状态有关。还有研究观察到COVID-19与抗磷脂抗体的关联,但是不同抗磷脂抗体亚型的相对比例及其致病性尚不清楚,随访检测也不全面。
在COVID-19暴发之前,一些证据表明严重感染可触发急性脑卒中,可能是由于炎症增加及其导致的血栓形成。
与流感相比,COVID-19引起缺血性脑卒中的风险似乎更高。
●心源性栓塞
COVID-19感染相关的心功能不全也可能是栓塞性脑卒中的潜在机制之一,可由SARS-CoV-2心肌炎直接导致,也可能是一般危重症相关心脏损伤或心功能不全的间接结果。COVID-19可导致各种心脏表现,包括心律失常、心衰和心肌梗死,其中很多都是心源性栓塞性脑卒中的易感因素。
●凝血病及抗凝治疗
在凝血病或接受抗凝治疗的患者中报道过自发性脑实质出血和皮层蛛网膜下腔出血。其中一些出血病例可能由未发现的缺血性事件随后发生出血性转化所致。
COVID-19合并颅内出血也与体外膜肺氧合(ECMO)的使用相关。
(2)诊断性评估
●COVID-19筛查
大流行期间,推荐在入院时对所有疑似脑卒中的患者都检测COVID-19。
●病因学检查
鉴于COVID-19相关脑卒中通常与典型的血管危险因素和传统的脑卒中机制有关,初始诊断性评估应遵循所有疑似脑卒中患者普遍采取的方法。确定潜在脑卒中机制的诊断性检查应包括脑和神经血管影像检查以及心脏评估,并针对确定的机制进行适当治疗。
推荐对所有COVID-19住院患者进行的常规检测包括:全血细胞计数(CBC)、血小板计数、凝血酶原时间(PT)、活化部分凝血活酶时间(aPTT)、纤维蛋白原以及D-二聚体。对于未明确COVID-19相关缺血性脑卒中机制的患者,我们检测高凝状态的方法与非COVID-19患者的方法相似。
(3)治疗相关问题
对仍在调查中的或COVID-19阳性患者的缺血性或出血性脑卒中的处理,治疗标准应与非COVID-19患者相同,但需要采取感染防控措施。
●溶栓和再灌注治疗
与所有脑卒中患者一样,应进行静脉溶栓治疗的评估。虽然静脉用组织纤溶酶原激活剂(tissue plasminogen activator, tPA;阿替普酶)对COVID-19患者的安全性尚未开展专门研究,但个案资料未见明显的安全性问题。
●急性抗血栓治疗
对于有明确的全剂量抗凝指征的缺血性脑卒中患者(如房颤、重度心衰),鉴于COVID-19患者有较高的血栓形成风险,只要出血风险可耐受,应早期启动抗凝治疗。对于其他缺血性脑卒中患者,无论有无COVID-19,一般都需尽早使用阿司匹林。在决定最佳抗血栓治疗时,应考虑具体评估全身疾病的严重程度、有无其他潜在血栓形成事件以及出血风险。
●疫苗诱导血栓性血小板减少患者的管理
若患者在接种COVID-19疫苗后发生CVT伴血小板减少,建议采用非肝素类药物(如,直接口服抗凝药)抗凝和静脉用免疫球蛋白(intravenous immune globulin, IVIG)治疗。
●ACEI和ARB治疗
如果没有其他原因需要停药(如低血压、急性肾损伤、缺血性脑卒中急性期需要允许性高血压),接受血管紧张素转化酶抑制剂(ACEI)或血管紧张素受体拮抗剂(angiotensin receptor blocker, ARB)治疗的患者应继续用药。起初有人推测,接受这些药物治疗的COVID-19患者出现不良结局的风险可能增加,但观察性研究的结果不支持这种推测。
●一般治疗
COVID-19成人住院患者的一般治疗,包括COVID-19特异性治疗,详见其他专题。(参见 “2019冠状病毒病(COVID-19):住院成人患者的处理”)
●脑卒中二级预防
与所有脑卒中患者一样,应针对血管危险因素(如高血压、糖尿病、高脂血症、房颤、吸烟)进行长期治疗,并适当采用抗血栓治疗。(参见 “缺血性脑卒中的二级预防概述”)
●长期风险
COVID-19感染急性期后,脑卒中发生率可能升高。一项纳入约580万美国退伍军人的研究发现,有既往COVID-19感染史者1年时脑卒中发生率高于对照组(HR 1.52,95%CI 1.4-1.6)。相比症状较轻者,COVID-19住院患者脑血管风险更高。原因不明,可能包括机体感染后处于促炎状态/存在内皮功能障碍,或大流行期间无法针对血管危险因素进行良好的随访和管理。
(4)严重程度和预后
COVID-19相关脑卒中可能比非COVID-19相关脑卒中的病情更严重。纽约市一家医院的报告显示,合并脑卒中的COVID-19患者的美国国立卫生研究院脑卒中量表(NIHSS)评分中位数高于有脑卒中但无COVID-19的同期对照者(NIHSS评分:19 vs 8)。此外,COVID-19缺血性脑卒中患者的死亡率和残疾率高于无COVID-19的缺血性脑卒中患者。一项分析显示,160例COVID-19合并脑卒中患者的院内死亡率为34%。这可能反映了COVID-19相关脑卒中更严重和/或COVID-19相关呼吸系统及其他全身并发症带来的合并症更严重。
(5)预防措施
对于有脑卒中病史或高危患者,医生应强调以下做法和推荐,同时适当纠正风险并采取其他脑卒中二级预防措施:
●同大流行发生前一样,应建议出现脑卒中症状者寻求急诊治疗。急性脑卒中有致残风险,甚至可能致命,即便在大流行期间,患者也应寻求最佳医疗服务,已证实可以改善脑卒中结局。急诊病房和医院已经能熟练地隔离COVID-19患者与其他患者,采取普遍预防措施防止感染播散,以及保护其他非COVID-19患者。经验表明,大流行期间可以实施高质量的脑卒中治疗。预防措施详见其他专题。(参见 “2019冠状病毒病(COVID-19):流行病学、病毒学和预防”,关于‘预防’一节)
●脑血管病患者应考虑准备额外的药物,以防需要居家隔离或药物供应中断。
●常规门诊就诊通常可以通过远程医疗安全有效地进行。基于短暂性脑缺血发作(transient ischemic attack, TIA)患者快速门诊评估系统的发展,或许可安全有效地开展TIA患者远程医疗随访。
●疫苗预防COVID-19感染并发症和死亡的益处远远超过了疫苗相关免疫性血栓性血小板减少症(vaccine-associated immune thrombotic thrombocytopenia, VITT)的风险。COVID-19引起血栓栓塞的风险似乎高于VITT风险。
据报道,接种腺病毒载体ChAdOx1 nCoV-19/AZD1222(阿斯利康COVID-19)和Ad26.COV2.S(杨森COVID-19)疫苗者中有血栓形成合并血小板减少发生,包括CVT伴或不伴出血。一项队列研究纳入了95例接种COVID-19疫苗后发生CVT的英国患者,发现VITT患者比非VITT致CVT者年轻(47岁 vs 57岁)、较少存在其他血栓栓塞危险因素(34% vs 56%)。但VITT患者有更广泛的颅内外血栓形成,死亡率更高(29% vs 4%)。在部分患者中,腺病毒载体DNA可能与血小板因子4结合,诱导生成自身抗体。这种自身免疫性VITT综合征见于疫苗接种后5-30日。
五、神经肌肉疾病
(1)吉兰-巴雷综合征
现偶有感染COVID-19后发生GBS的报道,但尚未明确COVID-19与GBS风险的潜在因果关系。一项英国的队列研究未能显示GBS与COVID-19明确相关。该研究中,2020年3-5月的GBS发病率低于之前4年同期水平,可能是由于这期间的社会封控措施减少了其他感染性诱因的传播。在意大利北部3家医院一个月内收治的约1200例COVID-19患者中,仅发现了5例GBS。
●临床特征
大部分合并GBS的COVID-19患者表现为在1-4日内进展的进行性上行性肢体无力。从COVID-19发病到出现肌无力的时间为5-16日,与其他GBS相关病毒感染观察到的情况相似。一项报告纳入国际GBS结局研究(International GBS Outcome Study, IGOS)中11例感染COVID-19后发生GBS的患者,发现73%存在感觉运动特征,64%有面瘫。其他报告表明与典型GBS相比,COVID-19相关GBS的症状进展更快、更严重;一项研究显示,5例患者中有3例需要机械通气。但很难区分呼吸衰竭是由GBS引起,还是由COVID-19相关肺病引起的。这项研究未报道自主神经失调症状。
COVID-19患者中也报道过Miller Fisher综合征和其他延髓变异型GBS。这些临床综合征以及GBS的鉴别诊断详见其他专题。(参见 “成人吉兰-巴雷综合征的发病机制、临床特征和诊断”)
●诊断性检查
当患者出现进行性肢体无力,以及胸部影像表现与呼吸功能不全不相称时,都应考虑GBS。GBS的评估和诊断标准详见其他专题。(参见 “成人吉兰-巴雷综合征的发病机制、临床特征和诊断”)
一项纳入5例COVID-19患者的研究观察到了以下诊断性检查特征:
与其他GBS患者一样,脑脊液分析示白细胞计数低或无白细胞。大多数患者脑脊液蛋白升高,但一项研究的5例患者中2例患者蛋白正常。脑脊液样本均未检出SARS-CoV-2。
电诊断检查结果提示轴突型GBS(远端运动潜伏期和速度正常、F波消失和纤颤)或脱髓鞘型GBS(远端运动潜伏期延长和传导阻滞)。
部分患者MRI示神经根强化。
●治疗和预后
合并GBS的COVID-19患者的治疗应与其他GBS患者相同。(参见 “成人吉兰-巴雷综合征的治疗和预后”)
一项研究中,所有患者接受IVIG治疗;有2例患者接受了两个IVIG疗程,1例启动了血浆置换法。至少1例患者在出院时能够独立行走,但这些患者的远期结局信息仍待确定。
接种COVID-19疫苗后发生GBS的风险:
由于腺病毒载体Ad26.COV2.S(杨森/强生)和ChAdOx1 nCoV-19/AZD1222(阿斯利康)COVID-19疫苗可能增加GBS风险,在得到进一步数据之前,我们建议有GBS病史者接种其他COVID-19疫苗。
美国和欧洲有接种腺病毒载体Ad26.COV2.S(杨森/强生)和ChAdOx1 nCoV-19/AZD1222(阿斯利康)COVID-19疫苗后发生GBS的病例,但尚未明确因果关系。在美国,接种1320万剂次Ad26.COV2.S疫苗后,有123例GBS在接种后6周内发生。疫苗接种后GBS的估计发生率高于背景发生率(8.4例/100,000人年 vs 2例/100,000人年,RR 4.18,95%CI 3.47-4.98)。从疫苗接种到症状出现的中位时间为13日,住院和呼吸衰竭的发生率分别为94%和14%。这在其他COVID-19疫苗中尚未有报道。这种风险详见其他专题。
(2)其他急性神经肌肉综合征
●肌炎
肌痛和乏力是COVID-19的常见症状,因此有人推测COVID-19可能导致病毒性肌炎;但尚缺乏确凿证据。据报道,在武汉11%的患者有肌肉损伤证据,肌酸激酶(creatine kinase, CK)升高至超过200U/L和/或肌痛。意大利的一项研究显示肌痛是常见主诉之一。3项病例报告描述了横纹肌溶解伴肌酸激酶>12,000U/L。其中一项病例报告显示,1例合并肌病的COVID-19患者接受肌肉活检,发现血管周围炎症及黏病毒抗性蛋白A(一种Ⅰ型干扰素诱导蛋白)沉积。病毒感染会导致组织中Ⅰ型干扰素病的毒性作用。
●局灶性和多灶性神经病
现已在COVID-19患者中报道了多种周围神经和神经丛综合征,包括:
•面神经麻痹
•动眼神经病变
•后组颅神经病变(迷走神经、副神经和舌下神经,Tapia综合征)
•多发性颅神经病
•神经痛性肌萎缩
●危重症神经病和肌病
相较于感染相关的GBS,危重症神经病和肌病往往出现在COVID-19病程的较晚期。
●俯卧位后的周围神经损伤
COVID-19相关ARDS患者置于俯卧位后可能出现周围神经损伤,尤其是臂丛损伤。一项研究中83例患者在重症COVID-19感染后收入康复机构,12例(14.5%)诊断为周围神经损伤,其中11例曾处于俯卧位。轴突损伤是最常见的神经损伤,主要发生在上肢。(参见 “成人急性呼吸窘迫综合征患者的俯卧位通气”,关于‘并发症’一节)
六、其他急性神经系统表现
个别病例报告还描述了COVID-19患者出现以下综合征(详见专题原文):
脑膜脑炎
菱脑炎
急性播散性脑脊髓炎和急性出血坏死性脑病
儿童多系统炎症综合征
癫痫发作和癫痫持续状态
全身性肌阵挛
RPLS
可逆性脑血管收缩综合征
七、COVID-19感染后持续存在的神经系统症状
(参见“COVID-19:急性疾病后持续性症状(长期COVID)成人患者的评估与处理”)
八、神经系统疾病患者的管理
虽然缺乏高质量的数据,但若患者在基线时已存在致失能的神经系统疾病,或在接受免疫抑制治疗,则应特别注意采取感染控制措施,包括疫苗接种、保持社交距离和戴口罩。
(1)COVID-19疫苗接种
某些神经系统疾病患者(包括使用免疫抑制剂者)感染COVID-19后可能易出现重症(表 2)。免疫抑制剂可能降低COVID-19疫苗的免疫原性和有效性。根据一般人群的数据,我们鼓励无禁忌证者在条件允许时尽快接种COVID-19疫苗,这与美国神经肌肉和电生理诊断医学协会及美国国家多发性硬化学会的指南一致。提高免疫抑制治疗者接种COVID-19疫苗效力的策略参见其他专题。(参见 “COVID-19:疫苗接种”,关于‘免疫功能受损者’一节)

表2
COVID-19疫苗接种,包括积极免疫抑制治疗致免疫功能受损者的疫苗接种和加强接种指导(表 3),详见其他专题。(参见 “COVID-19:疫苗接种”,关于‘美国的疫苗接种方法’一节和 “COVID-19:疫苗接种”,关于‘免疫功能受损者’一节)

表3
(2)免疫抑制治疗的管理
接受免疫抑制治疗的神经系统疾病患者感染COVID-19的风险似乎并未增高。大多数情况下应继续接受免疫抑制治疗,仅应在发生重症COVID-19时停止治疗。部分患者可能宜更换药物或调整治疗方案,具体取决于个体风险评估。
●多发性硬化
相比接受其他疾病修正治疗(disease-modifying therapy, DMT)的多发性硬化患者,接受B细胞耗竭性抗CD20或鞘氨醇-1-磷酸受体DMT者对SARS-CoV-2感染的抗体应答可能较弱。若条件允许,多发性硬化患者应先接种疫苗,后开始抗CD20 DMT治疗。对于已在接受抗CD20 DMT的患者,若病情稳定,可将DMT输注推迟至疫苗接种后数周,以提高体液免疫应答、增强疫苗效果。应根据疾病严重程度和活动性而个体化决策。多发性硬化的DMT详见其他专题。(参见 “多发性硬化的疾病修正治疗:药理学、用法及不良反应”)
一项研究纳入119例多发性硬化/视神经脊髓炎谱系疾病合并COVID-19患者,接受抗CD20 DMT者的血清转化率低于接受其他DMT者(48% vs 86%)。产生抗体应答者抗CD20输注与感染COVID-19之间的间隔比未产生抗体应答者更长(平均3.7个月 vs 1.9个月)。此外,据报道,接受奥瑞珠单抗治疗者接种SARS-CoV-2疫苗后体液免疫应答较弱,但T细胞应答得以保留,提示疫苗接种有一定效果。需进一步研究这些免疫治疗对疫苗接种的影响。
●重症肌无力
重症肌无力患者一般应继续接受免疫抑制治疗,以尽量降低神经肌肉疾病恶化的风险。对于部分在免疫抑制治疗时发生COVID-19的患者,也可考虑其他治疗。例如,免疫球蛋白治疗、补体抑制剂治疗和血浆置换预期都不会增加感染COVID-19的风险;但并非所有患者都适用以上治疗,不建议不加区别地换为上述治疗。
小型观察性研究中,COVID-19对重症肌无力患者的影响各不相同。部分病例出现了呼吸衰竭和病情加重。但其他一些经免疫抑制治疗得到良好控制的重症肌无力患者感染COVID-19后病情较轻。一项纳入93例重症肌无力合并COVID-19患者的研究发现,与病情重症(如,住院并需呼吸支持)相关的因素包括:发病前用力肺活量较低、功能状态较差、高龄和口服糖皮质激素剂量较高。现已创建由医生报告的登记系统(registry),来收集重症肌无力患者发生COVID-19的结局数据。
重症肌无力患者DMT的其他建议见其他专题。(参见 “重症肌无力的治疗概述”,关于‘COVID-19大流行期间的指导’一节)
(3)COVID-19重症风险
由于神经系统疾病可能加剧COVID-19预后,此类患者尤其需接种疫苗并采取其他预防措施。(参见 “2019冠状病毒病(COVID-19):流行病学、病毒学和预防”,关于‘预防’一节)
●脑血管疾病
一些危险因素与重症SARS-CoV-2感染的风险有关(表 2)。有心血管疾病史(包括脑卒中)的患者,感染SARS-CoV-2后的结局似乎更差。潜在原因如下:脑血管疾病患者通常存在其他心血管和代谢危险因素,导致他们感染COVID-19后更易出现不良结局;高血压、肥胖和糖尿病都可能造成COVID-19病情更严重和死亡率更高。COVID-19大流行在种族、族群、受教育程度和收入水平方面,表现出许多与脑血管疾病相同的差异性。因此,导致资源不足人群的少数族裔群体易感脑卒中的心血管因素(如肥胖、糖尿病),同样也使他们易感COVID-19并发症。此外,应用ACEI和ARB的患者出现ACE2上调,可能导致这些患者出现更严重的感染,但这在观察性研究中尚未证实。(参见 “COVID-19的临床特征”,关于‘重症的危险因素’一节)
●癫痫
有癫痫史者感染COVID-19后结局较差的风险似乎较高。一篇meta分析纳入13项观察性研究、57,000余例住院COVID-19患者,癫痫患者结局较差的风险较高(OR 1.71,95%CI 1.11-2.59)。这可能是因为癫痫发作和癫痫持续状态的不良影响、抗癫痫药物的不良反应,或利用的医疗资源不足导致癫痫控制不良。(参见下文‘医疗资源利用’)
●神经肌肉无力
基线存在心脏或呼吸功能障碍的患者,重度神经肌肉无力患者,以及其他严重影响日常活动能力的神经系统疾病(如肌萎缩侧索硬化症、多发性硬化)导致延髓肌无力的患者,其病情可能更严重,也可能无法恢复到基线状态。这是基于其他急性感染的观察结果,但在COVID-19情况下也可能适用。一项有关多发性硬化患者的登记研究发现,根据扩展残疾状态量表(Expanded Disability Status Scale, EDSS)测量结果,更严重的残疾与更严重的COVID-19有关;与一般人群相同,年龄和肥胖也是多发性硬化患者的危险因素。
●多发性硬化
接受B细胞耗竭性DMT的多发性硬化患者住院率可能较高。一项跨国队列研究纳入1683例多发性硬化患者,相比接受其他DMT者,接受奥瑞珠单抗或利妥昔单抗治疗者住院率更高(校正OR 1.75,95%CI 1.29-2.38;校正OR 2.76,95%CI 1.87-4.07)。这两种药物也与入住ICU风险较高相关,但均与死亡风险增高无关。
神经系统疾病患者在因COVID-19住院后,再入院的风险可能较高。509例最初因COVID-19住院的患者中,22%在随后4个月内再次入院接受评估(包括再住院)。相关危险因素包括高龄、合并症和既已存在的神经系统疾病。
痴呆患者及癫痫患者发生COVID-19的风险升高,且死亡率也更高。
(4)COVID-19特异性治疗
有症状的患者COVID-19特异性治疗的指征和方法根据临床情况和重症风险判定而异。一些患者因存在神经系统疾病而有重症风险,如痴呆患者或接受免疫抑制治疗的神经炎症性疾病患者(表 2)。COVID-19特异性治疗方法见其他专题。(参见 “2019冠状病毒病(COVID-19):急性成人患者的门诊评估与管理”,关于‘COVID-19特异性治疗’一节和 “2019冠状病毒病(COVID-19):住院成人患者的处理”,关于‘COVID-19特异性疗法’一节)
(5)医疗资源利用
大流行期间,远程医疗越来越多地用于管理慢性神经系统疾病门诊患者。一项对143例癫痫患者的调查显示,约1/3的患者可获得的门诊医疗服务减少,这与癫痫发作恶化相关。癫痫、偏头痛等神经系统疾病患者应酌情制定可在家中实施的挽救性治疗计划。(参见 “Telemedicine for adults”, section on ‘Telemedicine during COVID-19 pandemic’)
本文内容来自循证医学知识库UpToDate临床顾问《COVID-19:神经系统并发症及神经系统疾病管理》专题,仅供学习交流之用,不可作为临床诊疗依据。

