本文刊登于《中国实用妇科与产科杂志》2023,39(1):68-74
DOI:10.19538/j.fk2023010117
2022年12月20日,美国国立综合癌症网络(national comprehensive cancer network,NCCN)公布了《2023 NCCN妊娠滋养细胞肿瘤临床实践指南(第1版)》。与2022第1版指南相比,流程图有改变,但讨论部分未进行更新。现对新版指南进行简要介绍及讨论。
1. 2023年指南主要更新
1.1 葡萄胎部分更新 (1)在标题处去除了“非侵蚀性”,只保留“葡萄胎”。(2)监测:对于初始治疗后连续3次人绒毛膜促性腺激素(human chorionic gonadotrophin,hCG)阴性者,考虑每3个月检测1次hCG,共6个月。(3)脚注c修改为:“必要时考虑加用氨甲环酸。”
1.2 葡萄胎后妊娠滋养细胞肿瘤(post-molar gestational trophoblastic neoplasia,post-molar GTN)部分更新 经评估无子宫外转移且世界卫生组织(WHO)预后评分≤4分者考虑再次刮宫。
1.3 妊娠滋养细胞肿瘤部分更新 (1)低危型GTN更改为联合方案者,hCG正常后巩固2~3个疗程,去除了“首选2个疗程”。(2)高危型GTN或Ⅳ期患者,化疗后hCG未下降至正常,包括以下3种情况:hCG呈低水平平台、缓解后复发、以及对EMA/CO方案反应不好;后续治疗的选择包括:①EMA/EP;②EP/EMA;或③对EP/EMA不耐受患者,可选用含博来霉素、异环磷酰胺或紫杉醇的以铂类为基础的方案,以及可能的情况下同时考虑切除化疗耐药病灶。(3)胎盘部位滋养细胞肿瘤(placental site trophoblastic tumor,PSTT)/上皮样滋养细胞肿瘤(epithelioid trophoblastic tumor,ETT):随访监测部分将“PET-CT”更改为“FDG-PET-CT”。
1.4 GTN的系统治疗 (1)高危GTN的初始治疗推荐方案EMA/EP和EP/EMA中的顺铂剂量从60~75mg/m2更改为75mg/m2。(2)高危GTN免疫治疗部分将帕姆单抗和纳武单抗作为首选的PD-1抑制剂。
1.5 妇科疾病幸存者指导原则 增加了关于后续妊娠的内容。推荐:在孕早期行超声检查确认宫内妊娠;胎盘行病理学评估;产后6周检测hCG,以证实降至正常水平。
2. 指南的主要内容
2.1 葡萄胎的初始治疗 对于葡萄胎患者,首先需要进行全面的病史采集及体格检查,推荐的辅助检查包括盆腔超声、胸部X线检查(如果胸部X线提示转移,则行胸部/腹部/盆腔CT和脑部MRI检查,并且在初次清宫后即按照妊娠滋养细胞肿瘤处理)、hCG定量检测、全血细胞分析、肝肾功能、甲状腺功能、血生化检查及血型筛查。如果hCG升高而影像学未发现疾病证据,考虑可能存在黄体生成素(luteinizing hormone,LH)交叉反应、垂体分泌的hCG或幻影hCG。此时需要与实验室检测人员沟通,采用连续稀释法或比较血清和尿液hCG,以鉴别幻影hCG。如果Rh阴性,需要给予抗D免疫球蛋白。
治疗前可根据患者有无生育需求选择:(1)负压吸宫和刮宫术,最好在超声监测下进行,以减少子宫穿孔的机会。(2)全子宫双侧输卵管切除术。
2.1.1 负压吸宫和刮宫术 先吸宫,然后用最大号刮匙刮宫。吸宫开始后可使用促子宫收缩药物,必要时加用氨甲环酸。尽管有证据表明,清宫术时行预防性化疗可将葡萄胎后GTN的发生率降低3%~8%,但目前对于预防性化疗仍有争议。有证据表明,对于有恶变高危因素的完全性葡萄胎患者,预防性化疗可降低其进展为GTN的概率。指南指出,有发生葡萄胎后GTN高危因素且无法进行hCG随诊或hCG随诊结果不可靠的患者,可考虑在清宫时给予甲氨蝶呤(methotrexate,MTX)或放线菌素D(dactinomycin,Act-D)预防性化疗。发生葡萄胎后GTN的高危因素包括:年龄>40岁,hCG>100 000 U/L,子宫异常增大,黄素化囊肿直径>6 cm。
2.1.2 全子宫双侧输卵管切除术 对于无保留生育要求的葡萄胎患者,可考虑行全子宫双侧输卵管切除术。
对于获得的组织需要进行组织病理学检查和基因分型。一方面有助于证实良性、非侵蚀性葡萄胎的诊断;另一方面可以分流出进展为葡萄胎后GTN的低危患者(即部分性葡萄胎患者),使其避免接受不必要的预防性化疗。
2.1.3 随访 经清宫或全子宫切除诊断为完全性或部分性葡萄胎后需要进行正规的随访。初始治疗后1个月进行病史采集和体格检查;治疗后每1~2周行hCG检测直到正常,然后继续检测hCG至连续3次正常后,考虑每3个月1次,共6个月。在监测过程中,如hCG水平处于平台或上升,则按葡萄胎后GTN处理。规律的随访能够早期发现GTN,从而减少多药联合化疗的应用。葡萄胎患者治疗后建议全身激素避孕(首选口服避孕药),与宫内节育器 (intrauterine devices,IUDs)相比,其可以抑制内源性LH和卵泡刺激素(follicle-stimulating hormone,FSH),而这2种激素可能干扰低水平hCG的检测。
2.1.4 葡萄胎后GTN的诊断 具有下述条件之一即可诊断葡萄胎后GTN:(1)hCG水平至少3周连续4次测定呈平台(±10%)。(2)hCG水平至少2周连续3次测定上升(≥10%)。(3)组织病理学诊断为绒毛膜癌、PSTT/ETT。(4)出现转移病灶。
2.1.5 葡萄胎后GTN的初始治疗 治疗方法需依据临床特征、诊断手段以及病灶部位而定。依据hCG变化诊断的葡萄胎后GTN,在治疗前需要进行病史采集和体格检查(包括盆腔检查),以及盆腔多普勒超声和胸部X线检查或胸部/腹部/盆腔CT,确定国际妇产科联盟(FIGO)分期及预后评分。盆腔多普勒超声用于排除妊娠,测量子宫大小,确定子宫内肿瘤的体积和血供。若胸部X线检查正常,则不需要进行其他影像检查即可开始治疗;若胸部X线检查提示转移,则需要进行胸部/腹部/盆腔CT和脑部MRI检查。
初始治疗方法根据是否存在子宫外转移而定。若无子宫外转移,有3种治疗选择:(1)WHO预后评分≤4分者,考虑再次刮宫。(2)单药化疗(MTX或Act-D)。(3)全子宫双侧输卵管切除术。治疗后每2周检测1次hCG,直至连续3次正常,然后改为每个月检测1次,连续监测6个月。若监测过程中hCG 持续高水平(平台或上升),则需要根据患者对初始治疗的反应及hCG升高水平选择化疗方案(见下文2.3.1.1部分)。若存在子宫外转移,则根据预后评分及FIGO分期分为低危型和高危型,再给予相应方案化疗。
依据组织病理学诊断的绒癌、PSTT/ETT和(或)出现转移性病灶的GTN,直接按照GTN处理。
2.2 GTN的分期和预后评分系统 采用FIGO分期系统(见表1)和预后评分系统(见表2)。

2.3 妊娠滋养细胞肿瘤的初始治疗 治疗前需要进行下列检查:(1)病史采集和全面体格检查,为避免出血的风险,不要对下生殖道可见病灶进行活检。(2)全血细胞分析、肝肾功能、甲状腺功能和生化检查。(3)影像学检查:胸、腹和盆腔增强CT(如果有增强的禁忌证,可考虑进行其他的影像学检查如MRI),以及盆腔超声或MRI。若有肺转移,则应考虑同时存在脑转移的可能性,故行脑部增强MRI(首选)或增强CT检查。(4)hCG测定:若hCG升高但影像学检查未发现疾病证据,考虑可能存在LH交叉反应或幻影hCG(指由于人体内存在能与动物抗体结合的嗜异性抗体,从而造成的假性低水平升高的hCG),此时需要与实验室检测人员沟通,采用连续稀释法或比较血清和尿液hCG,以鉴别幻影hCG。若hCG升高但高糖基化hCG正常,则可能提示为静止期GTN,不需要进一步治疗。(5)确定FIGO分期和预后评分。(6)组织病理学评价。NCCN工作组推荐将组织病理学评价作为初始评估的一个部分,原因在于不同GTN亚型的推荐治疗存在很大差异。因此,为避免对患者进行不必要的治疗并使其达到最佳预后,必须进行精准诊断。
根据上述检查可将GTN大致分为以下3种情况:(1)低危GTN,即预后评分<7分者。(2)高危GTN,即预后评分≥7分或Ⅳ期者。(3)中间型滋养细胞肿瘤(intermediate trophoblastic tumors,ITTs),即PSTT和ETT,它们不适合应用预后评分系统。
2.3.1 低危GTN的治疗 用单药方案化疗,可选择的药物包括MTX和Act-D。
2.3.1.1 治疗中监测 在开始每疗程治疗前监测hCG,每2周1次,根据hCG水平变化指导后续处理。在治疗及监测过程中可能出现以下3种情况:(1)化疗后hCG下降至正常,然后继续化疗2~3个疗程(首选3个疗程),停止化疗。(2)对初始化疗反应好,但随后hCG下降呈平台(经过3个疗程化疗后,hCG水平下降<10%)或下降后再次上升(hCG<1000U/L),则可更改为初始治疗时没有使用过的另一种单药方案。如果之前用MTX可更改为Act-D,之前用Act-D可更改为MTX。若病灶局限于子宫且无生育要求时,可考虑同时行全子宫双侧输卵管切除术,即使存在卵巢黄素化囊肿,手术时也可以原位保留双侧卵巢。更改治疗方案后,如hCG下降至正常,继续化疗2~3个疗程(首选3个疗程),停止化疗;如hCG水平呈平台(经过2个疗程化疗后,hCG水平变化<10%)或上升(经过1个疗程化疗后,hCG水平上升>10%),则需再次评价转移情况并改为依托泊苷、MTX、Act-D、环磷酰胺和长春新碱(EMA/CO)联合化疗。(3)对初始化疗反应好,但随后hCG水平快速上升(hCG≥1000U/L)或对初始化疗反应不好(经过3个疗程化疗后,hCG水平呈平台,变化<10%;或者经过2个疗程化疗后,hCG水平上升>10%),则需将单药化疗更改为EMA/CO联合化疗,并再次评价转移情况,并考虑行全子宫双侧输卵管切除术。更改为联合化疗方案后,如hCG下降至正常,继续化疗2~3个疗程,停止化疗;如hCG水平呈平台(经过2个疗程化疗后,hCG水平变化<10%)或上升(经过1个疗程化疗后,hCG水平上升>10%),则需改用铂类为基础的化疗方案,并且在可能的情况下,考虑手术切除耐药病灶,尤其是子宫切除术和肺叶切除术。第(2)和第(3)两种情况的治疗考虑咨询妊娠滋养细胞疾病管理中心的专家。
2.3.1.2 随访及避孕 每个月监测hCG,持续12个月。对于葡萄胎后GTN和绒毛膜癌患者,hCG是一个可靠的肿瘤标志物,因此在hCG正常后的随访过程中不推荐行影像学检查。患者需采取避孕措施,首选口服避孕药。
2.3.2 高危GTN的治疗 采用EMA/CO方案化疗,考虑咨询妊娠滋养细胞疾病管理中心的专家。
有脑转移者,可考虑:(1)增加MTX和甲酰四氢叶酸的剂量。(2)考虑头颅放疗,头颅立体定向放疗±鞘内注射MTX或者全脑放疗(总量30 Gy,分割为15次,每次2.0 Gy)。
广泛转移且预后评分>12分,有肺出血、腹腔内出血、颅内出血的高危患者,可考虑先给予低剂量依托泊苷和顺铂(EP)方案诱导化疗,1~3个疗程后,再予以EMA/CO方案化疗。
治疗期间,每2周检测1次hCG,可能出现以下4种情况:(1)hCG下降至正常。(2)EMA/CO化疗反应好,但随后出现hCG持续低水平平台。(3)缓解后复发。(4)对EMA/CO方案反应不好。后3种情况,后续治疗的选择包括:(1)依托泊苷、MTX、Act-D、依托泊苷和顺铂方案(EMA/EP)。(2)依托泊苷、顺铂、依托泊苷、MTX和Act-D方案(EP/EMA)。(3)对EP/EMA不耐受患者,可选用含博来霉素、异环磷酰胺或紫杉醇的以铂类为基础的方案,可能的情况下同时考虑切除化疗耐药病灶。
经以上治疗hCG降至正常后,继续化疗2~3个疗程,然后监测,内容同上文2.3.1.2部分。
2.3.3 中间型滋养细胞肿瘤的治疗 需要根据有无转移性病灶而定,考虑咨询妊娠滋养细胞疾病管理中心的专家。无转移性ITTs的生存率约为100%,而转移性ITTs为50%~60%。对于具有距离末次已知妊娠的时间间隔≥48个月不良预后因素的患者,以铂为基础化疗方案的应用增加,提高了其总生存率。
2.3.3.1 无转移性中间型滋养细胞肿瘤(Ⅰ期) 推荐行全子宫双侧输卵管切除术±盆腔淋巴结活检。Lan等的回顾性研究表明,临床Ⅰ期的PSTT或ETT发生盆腔淋巴结转移的概率为5%~15%。因此,在进行全子宫双侧输卵管切除术时,可考虑行盆腔淋巴结活检,尤其对于病灶较大、浸润深度较深者。术后具有1个或多个不良预后因素者考虑系统治疗,不良预后因素为距前次妊娠的时间间隔≥2年、深部浸润、有坏死、有丝分裂指数>5/10个高倍视野。如无不良预后因素,术后直接观察。
2.3.3.2 转移性中间型滋养细胞肿瘤 推荐行全子宫双侧输卵管切除术,如有可能,切除转移性病灶。同时给予以铂类为基础的方案,如:(1) EMA/EP。(2) EP/EMA。(3)紫杉醇、顺铂、紫杉醇和依托泊苷方案(TP/TE)。(4)其他方案,如博来霉素、依托泊苷和顺铂方案(BEP),依托泊苷、异环磷酰胺和顺铂方案(VIP),或异环磷酰胺、卡铂和依托泊苷方案(ICE)。
尽管与葡萄胎后GTN相比,hCG不能作为ITTs的一个可靠的标志物,但是治疗后也应该像其他GTN一样监测hCG水平。NCCN工作组推荐使用FDG-PET-CT进行随访监测,检查时间为化疗结束时、以及其后每6~12个月检查1次,共2~3年。随访期间,无转移性ITTs出现疾病复发或进展予以化疗,可选择初始治疗时可选择的化疗方案;转移性ITTs出现疾病复发或进展,予以化疗或给予最好的支持治疗(参见NCCN姑息治疗指南)。
2.4 GTN的化疗
2.4.1 低危GTN的化疗方案
2.4.1.1 MTX单药方案(首选方案) MTX方案有:(1)MTX 0.4 mg/(kg∙d)(最大量25 mg/d),静脉滴注(首选)或肌肉注射,每日1次,第 1~5天,每14d重复(1级证据)。(2)MTX 1mg/(kg∙d),肌肉注射,第1、3、5、7天,甲酰四氢叶酸15 mg口服(首选)或肌肉注射,每次MTX用药后30h,第2、4、6、8天,每14d重复(1级证据)。
在应用MTX化疗时,需要注意下列事项:(1)多日MTX化疗方案是低危GTN一线化疗的标准方案。对于MTX毒性反应大或者有MTX应用禁忌证的患者,最常选用的二线方案是Act-D 5d方案。(2)不推荐使用单次MTX方案,如MTX 30~50 mg/m2肌肉注射,每周1次;或者MTX输注(例如300 mg/m2,连续输注超过12h并联合使用甲酰四氢叶酸),因为这2种方案的疗效较差。
2.4.1.2 Act-D单药化疗方案(首选方案) Act-D方案有:(1)Act-D 0.5 mg固定剂量静脉滴注,第1~5天,每14d重复(首选,1级证据)。(2)Act-D 1.25 mg/m2(最大剂量2 mg),脉冲推注,1次,每14d重复(1级证据)。
在应用Act-D化疗时,需要注意Act-D静脉推注的脉冲给药方案不能用作MTX耐药的二线化疗或者诊断为绒癌患者的初始治疗方案。
2.4.2 高危GTN的化疗方案
2.4.2.1 EMA/CO方案(首选方案) 每2周重复,直至hCG正常,继续巩固化疗6~8周。具体方案如下:依托泊苷 100 mg/m2静脉滴注,第1~2天;Act-D 0.5 mg静脉推注,第1~2天;MTX 300 mg/m2静脉滴注(超过12h),第1天;甲酰四氢叶酸15 mg口服(首选)或肌肉注射每12h 1次,共4次,MTX开始给药24h后开始;环磷酰胺600 mg/m2静脉滴注,第8天,长春新碱0.8 mg/m2(最大剂量2 mg)缓慢静脉推注(>5~10 min),第8天。
对于有广泛转移(预后评分>12分者)患者,由于其发生肺出血、腹腔内出血或颅内出血的风险较高,可考虑在给予EMA/CO方案化疗前,先给予低剂量EP方案诱导化疗1~3个疗程。
为二级预防粒细胞缺乏性发热或者预防治疗延迟,可在每疗程EMA/CO方案的第4~6(7)天和第10~12(13)天给予非格司亭5μg/kg,每周3~4d。
对于脑转移者,MTX输注剂量增加为1000mg/m2,输注时长从12h延长至24h,在MTX输注开始32h后给予甲酰四氢叶酸口服,剂量为15mg,每6h 1次,共12次。
2.4.2.2 EMA/EP方案和EP/EMA方案(可考虑的方案) 有以下2种情况者EMA/EP方案和EP/EMA方案是可以考虑的最恰当的化疗方案:(1)对EMA/CO方案有反应,但hCG呈低水平平台或升高。(2)对EMA/CO方案完全反应后,hCG再次升高者。
EMA/EP方案:每2周重复,EMA和EP每周交替使用,达到血清学缓解后再巩固6~8周。依托泊苷 100 mg/m2静脉滴注,第1天;MTX 300 mg/m2静脉滴注,超过12h,第1天;甲酰四氢叶酸15 mg口服(首选)或肌肉注射,每12h 1次,共4次,MTX开始给药24h后开始;Act-D 0.5 mg静脉推注,第1天;依托泊苷 100~150 mg/m2静脉滴注,第8天,顺铂 75 mg/m2静脉滴注,第8天。非格司亭5μg/kg皮下注射,每个周期的第9~14天使用。根据机构规定的体重限制,非格司亭剂量取整至最接近药品规格。
EP/EMA方案:每2周重复,EP和EMA每周交替使用,达到血清学缓解后再巩固6~8周。依托泊苷100~150mg/m2静脉滴注,第1天;顺铂75 mg/m2静脉滴注,第1天;依托泊苷100mg/m2静脉滴注,第8天;MTX 300 mg/m2静脉滴注,超过12h,第8天;甲酰四氢叶酸15 mg口服(首选)或肌肉注射,每12h 1次,共4次,MTX开始给药24h后开始;Act-D 0.5 mg静脉推注,第8天,同时非格司亭5μg/kg皮下注射,每个周期的第3~6天和第10~13天使用。
对于脑转移者,MTX剂量增加及注意事项同EMA/CO方案。
2.4.2.3 EP诱导化疗方案 每周重复,依托泊苷100mg/m2静脉滴注,第1~2天;顺铂20mg/m2静脉滴注,第1~2天。对于有广泛转移(预后评分>12分)的患者,由于其发生肺出血、腹腔内出血或颅内出血的风险较高,可考虑在EMA/CO、EMA/EP或EP/EMA前使用,共1~3个疗程。
2.4.3 MTX耐药性高危GTN的治疗 下文2.4.3.1~2.4.3.4部分为首选方案,2.4.3.5部分为其他推荐方案,2.4.3.6~2.4.3.9部分为某些情况下有用的方案。
2.4.3.1 TP/TE方案 每4周重复,TP和TE每2周交替使用。第1天,紫杉醇135mg/m2静脉滴注,顺铂 60~75mg/m2静脉滴注;第15天,紫杉醇135 mg/m2静脉滴注,依托泊苷150 mg/m2静脉滴注。在第2天和第16天使用聚乙二醇非格司亭 6mg皮下注射。
2.4.3.2 BEP方案 每3周重复。博来霉素 30U,静脉滴注,第1、8、15天或者第2、9、16天,依托泊苷100 mg/(m2∙d)静脉滴注,第1~5天,顺铂20 mg/(m2∙d)静脉滴注,第1~5天。聚乙二醇非格司亭6 mg皮下注射,第8天,或非格司亭5μg/kg皮下注射,第6~14天。在治疗前进行基线肺功能检查(pulmonary function tests,PFTs),一般是行肺活量和一氧化碳弥散功能(diffusing capacity for carbon monoxide,DLCO)测定,并根据临床情况在每个周期治疗前复测PFT。
2.4.3.3 VIP方案 每3周重复。依托泊苷75mg/(m2∙d)静脉滴注,第1~5天;异环磷酰胺1200 mg/(m2∙d)静脉滴注,第1~5天;在每天使用异环磷酰胺前15min予美司钠120mg/(m2∙d)单次静脉推注,待每天异环磷酰胺用药结束后再予1200mg/(m2∙d)静脉滴注,维持超过12h;顺铂 20mg/(m2∙d)静脉滴注,第1~5天。聚乙二醇非格司亭6mg皮下注射,第5天,或非格司亭5 μg/kg皮下注射,第6~14天。
2.4.3.4 ICE方案 每3周重复。异环磷酰胺 1.2 g/(m2∙d)静脉滴注,第1~3天;在每天使用异环磷酰胺前15min予美司钠 120 mg/m2单次静脉推注,待每天异环磷酰胺用药结束后再予1200 mg/m2静脉滴注,维持超过12h;卡铂按照曲线下面积(area under curve,AUC)4计算用药剂量,静脉滴注,第1天;依托泊苷 75 mg/(m2∙d)静脉滴注,第1~3天。聚乙二醇非格司亭6mg皮下注射,第4天,或非格司亭300 μg皮下注射,第6~14天。
2.4.3.5 TIP方案 每3周重复。紫杉醇 250 mg/m2静脉滴注,第1天;异环磷酰胺1500 mg/(m2∙d)静脉滴注,第2~5天;美司钠300 mg/m2静脉推注,每天使用异环磷酰胺前15min及开始使用异环磷酰胺后的4h、8h分别给药1次;顺铂25 mg/(m2∙d)静脉滴注,第2~5天。
2.4.3.6 PD-1/PD-L1抑制剂[例如:帕姆单抗(首选),纳武单抗(首选),阿瓦鲁单抗] 帕姆单抗200mg静脉滴注,每3周1次,或者400mg静脉滴注,每6周1次;纳武单抗240 mg静脉滴注,每2周1次,或者480 mg静脉滴注,每4周1次;阿瓦鲁单抗800 mg静脉滴注,每2周1次。
2.4.3.7 卡培他滨为基础的方案 每3周重复。卡培他滨 1250mg/m2口服,每天2次,共2周,间隔1周,然后开始下一疗程。
2.4.3.8 吉西他滨±顺铂 每4周重复。吉西他滨600~800mg/(m2·d)静脉滴注,第1、8、15天;顺铂25~30mg/(m2·d)静脉滴注,第1、8、15天。
2.4.3.9 其他 大剂量化疗联合外周血干细胞移植。
2.4.4 中间型滋养细胞肿瘤(PSTT和ETT)的化疗
2.4.4.1 首选方案 EMA/EP、EP/EMA和TP/TE。
2.4.4.2 其他推荐方案 BEP、VIP、ICE。
2.4.4.3 某些情况下有用的方案 PD-1/PD-L1抑制剂,卡培他滨为基础的方案,吉西他滨±顺铂,大剂量化疗联合外周血干细胞移植。
2.5 病理诊断原则
2.5.1 手术操作 扩宫和刮宫术,全子宫切除术。
2.5.2 良性、非侵袭性葡萄胎的病理诊断 见表3。病理仅报告组织学类型,如出现子宫肌层或脉管侵犯(即侵蚀性葡萄胎),需要用恶性GTN的病理评估标准。
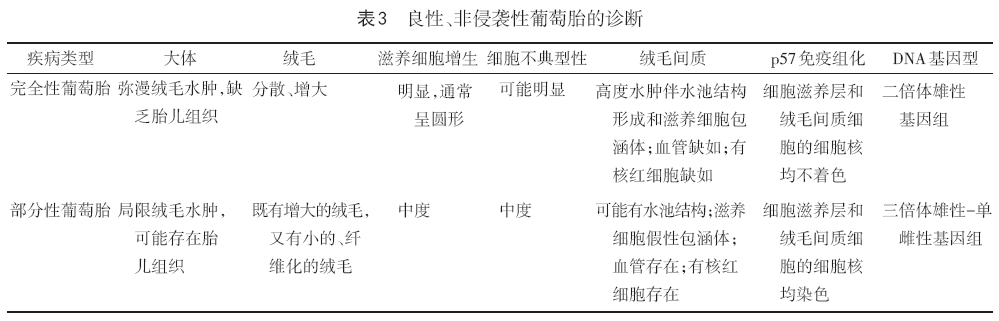
2.5.3 恶性GTN病理评估包括 (1)肿瘤位置(包括:子宫体、子宫颈、其他、不能确定)。(2)肿瘤大小(以cm表示)。(3)组织学类型:①葡萄胎,侵蚀性葡萄胎;②绒毛膜癌;③胎盘部位滋养细胞肿瘤;④上皮样滋养细胞肿瘤;⑤不能明确类型的恶性滋养细胞肿瘤。(4)累及的组织/器官(列出肿瘤累及的所有器官以便于评估)。(5)标本边缘状态(可评估的部位,边缘如为阴性,报告则可能需要包括最近的切缘以及病灶与最近切缘的距离)。(6)淋巴脉管间隙浸润。良性的滋养细胞肿瘤/病变(包括:胎盘部位过度反应,胎盘部位结节)属于良性,不适用于以上病理报告评估原则。表4列出了用于鉴别诊断GTN的免疫组化标志物。见表4。对于良性和恶性滋养细胞增生,GATA-3都是一个敏感的指标,因此可能可以用来鉴别GTN和非GTN肿瘤。

2.6 妇科疾病幸存者指导原则
2.6.1 生理影响 妇科恶性肿瘤典型的治疗方法通常包括手术、化疗、激素治疗、放疗和(或)免疫治疗。这些治疗会引起急性、短期和长期毒性反应。手术治疗范围可以很广泛,从而导致粘连形成,进而可能会引起疼痛和小肠梗阻,出现泌尿系或胃肠道并发症(如失禁、腹泻),盆底功能障碍[表现为一系列对泌尿系、肠道和(或)性功能的影响]和淋巴水肿。尽管常用的化疗方案可能会导致神经毒性、心脏毒性、继发血液系统肿瘤和认知功能障碍的风险增加,但具体化疗方案的不良反应有所不同。长期缺乏雌激素可能会出现类似更年期症状,如潮热、阴道干燥和骨质丢失。放疗可能会导致长期并发症(如纤维化,外阴阴道萎缩),并使其易罹患继发性皮下组织癌和(或)邻近照射野下方的器官恶变。免疫治疗是一种新兴疗法,迄今为止,这些疗法的长期影响尚不明确。
2.6.2 社会心理影响 恶性肿瘤对患者的社会心理影响本质上可能是心理影响(如抑郁、焦虑、对复发的恐惧、身体形象改变)、财务影响(如重返工作岗位的问题、保险问题)和(或)人际交往的影响(如人际关系、性及亲密感)。
2.6.3 临床指导方法 所有妇科恶性肿瘤幸存者应定期接受常规医疗检查,重点针对管理慢性疾病,监测心血管危险因素,提供接种疫苗的建议以及鼓励采取健康的生活方式。为了评估妇科恶性肿瘤治疗的迟发性和长期影响,临床医生应详细记录患者的病史,进行全面的体格检查以及必要的影像学和(或)实验室检查。所有患者(不论是否性活跃),都应询问其泌尿生殖道症状,包括外阴阴道干燥。建议患者转诊至相应的专科就诊咨询(例如理疗、盆底治疗、性治疗、心理治疗)。由于大多数妇科恶性肿瘤治疗方法会导致性功能障碍、早绝经和不孕。因此,需要特别注意由此造成的医疗和社会心理影响。建议在放疗后使用阴道扩张器和保湿剂。对于绝经前患者,应考虑应用激素替代治疗。与所有参与肿瘤幸存者医疗的临床医生(包括初级临床医生)的沟通和协调至关重要。推荐为恶性肿瘤幸存者提供其治疗总结和随访建议。
2.6.4 后续妊娠 推荐在孕早期行超声检查确认宫内妊娠;胎盘行病理学评估;产后6周检测hCG以证实降至正常水平。
3. 讨论
3.1 葡萄胎标题处的变化 根据2020年10月国际癌症研究机构发布的第5版《WHO女性生殖器官肿瘤分类》中[1],葡萄胎包括完全性葡萄胎、部分性葡萄胎、侵蚀性和转移性葡萄胎。完全性及部分性葡萄胎需要依靠病理组织学和DNA基因分型达到精准诊断。侵蚀性葡萄胎是指侵犯子宫肌层或子宫血管的葡萄胎。转移性葡萄胎可表现为子宫外部位见葡萄胎绒毛,最常见的部位是阴道壁/骨盆。后二者的特征性表现为在葡萄胎治疗后,血清hCG水平先下降,然后持续升高,伴阴道流血。因此,侵蚀性或转移性葡萄胎的诊断多数情况下较葡萄胎的诊断滞后,在前期阶段处理及监测与非侵蚀性葡萄胎相同。新版指南中标题中去除“非侵蚀性”,只保留“葡萄胎”更加贴近临床实践。
3.2 葡萄胎清宫后的随访 关于葡萄胎清宫后的随访,NCCN指南和FIGO指南存在差异。2022版NCCN指南中明确指出“治疗后每1~2周行hCG检测直到正常,然后继续检测hCG至连续3次正常后,每3个月1次,共6个月”。新版指南增加了“考虑”二字,也就是说可能有变动的余地。FIGO指南从2018版开始依据英国Charing Cross医院Coyle等[2]对20 144例葡萄胎患者进行的回顾性分析,发现清宫后血hCG自然转阴者,完全性葡萄胎(CHM)进展为GTN的概率为0.25%,其中>56 d自然转阴者进展为GTN的概率是≤56 d转阴者的3.8倍;而PHM进展为GTN的概率为0.03%。根据这项研究,将英国葡萄胎患者自然转阴者的随访计划修订为部分性葡萄胎(PHM)患者在血hCG自然转阴后1个月再进行1次尿液检测即可,而CHM的随访为hCG正常后每个月测定1次hCG,连续6个月。2021版FIGO指南依然用此随访方法。因此,如能精准诊断CHM和PHM,建议依据FIGO指南进行随访。
3.3 葡萄胎后GTN选择再次扩宫和刮宫者的标准 2022版NCCN指南中通过hCG变化诊断葡萄胎后GTN患者,经评估后如无子宫外转移,再次扩宫和刮宫是治疗选择之一。新版指南中将再次扩宫和刮宫的对象限制在WHO预后评分≤4分者,也就是FIGO指南中提出的5~6分的较高危险评分者不建议选用此种方法,可选择的治疗方法为直接单药化疗或全子宫双侧输卵管切除术。NCCN指南做此推荐的初衷可能是提高治疗的成功率。2016年,GOG的一项多中心、前瞻性Ⅱ期临床试验[3]评价二次刮宫对低危无转移GTN的有效性和安全性。根据WHO预后评分(低危者为评分0~6分)进行分组,纳入的指标包括年龄、hCG值、盆腔超声所见、胸部X线。最终有60例新诊断的低危无转移GTN患者可进行评估,其中2例患者为WHO预后评分5分,3例为6分。经过二次刮宫40%(24/60)的患者达到治愈,从而避免了化疗。2例患者(3%)未完成随访,但在失访前hCG已经降至正常。根据年龄进行分层,≤19岁者,治愈率为25%(1/4);≥40岁者,治愈率为16.7%(1/6)。当WHO预后评分≤4分时,二次刮宫的治愈率为43.6%(24/55),而预后评分为5分或6分者均未通过刮宫手术达到治愈(0/5)。另外,不同的hCG值,二次清宫的成功率不同。当hCG在100~1500U/L时,成功率为53%(10/19);hCG在1500~5000U/L时,成功率为40%(4/10);hCG在5000~10 000 U/L时,成功率为29%(2/7);hCG在10 000~100 000U/L时,成功率为40%(8/20);hCG超过100 000 U/L时,没有患者可以通过二次清宫hCG转阴(0/3)。通过此研究,可以得出结论,对于新诊断的葡萄胎后GTN患者,且WHO预后评分为0~4分者,可从二次清宫术中获益。而对于需要保留生育功能的5~6分且位于生育年龄两端的患者(≤19岁或>39岁),可首选化疗。
3.4 免疫治疗在GTN中的应用 2017年Huang等[4]首次报道了免疫治疗用于化疗耐药GTN的病例。同年,Ghorani等[5]报道了Pembrolizum在4例化疗耐药滋养细胞肿瘤中的疗效。在该研究中,有3例获得完全缓解,并且均在停止治疗后24、15和5个月时保持缓解,此4例患者的肿瘤PD-L1表达水平均在90%以上。之后发表的研究中有2项为临床研究,其余为病例报告。最早的关于GTT的临床研究是2020年法国的Ⅱ期单臂多中心临床研究[6],共纳入15例单药耐药的患者,给予阿瓦鲁单抗治疗,有效率为53%(8/15)。这项研究的意义在于为单药化疗失败的患者提供了非化疗的另一个选择。另外,一项临床研究是2021年发表于Lancet Oncology,由北京协和医院向阳教授领衔进行的第一个前瞻性评估PD-1抑制剂联合VEGFR抑制剂用于高危难治性或复发性GTN的Ⅱ期临床研究[7]。此研究的客观缓解率(ORR)为55%(11/20),完全缓解率(CR)为50%(10/20)。达到CR者随访过程中均无疾病复发,为多线耐药或复发的难治性GTN提供了另外一种治疗选择。
3.5 葡萄胎和GTN后的生殖结局及监测 妊娠滋养细胞疾病多数为生育年龄女性,且随着手术、有效化疗药物及方案的应用,治愈率非常高。经过治疗后,许多患者面临着再次妊娠的问题。既往有1次CHM或PHM病史者,继发妊娠再次发生葡萄胎的概率为0.7%~2.6%,即患病风险增加到散发性葡萄胎的10倍。第2次葡萄胎的风险在首次诊断后次年发生率最高,之后下降。如果既往有2次CHM病史,则发病风险增加到约10%。既往接受过化疗的GTN患者,随着依托泊苷剂量的蓄积,发生急性骨髓性白血病的风险增加。对这些患者生育结局的研究发现,活产率高达70%,且不伴先天性出生缺陷率的增加。但是与普通生育年龄女性人群相比,死产的风险稍增加。因此,对于既往有GTD病史者,再次妊娠后,孕早期行超声检查确认宫内妊娠;胎盘行病理学评估;产后6周检测hCG以证实转阴性均非常有必要[8]。另外,我们建议有GTD病史者,之后的每次妊娠终止后,包括人工流产、足月产、异位妊娠,都应将组织物送病理学评估,并在妊娠终止后6周行hCG检测。
参考文献
[1] WHO Classification of Tumours Editorial Board. WHO Classification of Tumours·5th Edition Female Genital Tumours [M]. Int Ag Res Cancer,2020:317-322.
[2] Coyle C,Short D,Lauren J,et al.What is the optimal duration of human chorionic gonadotrophin surveillance following evacuation of a molar pregnancy?A retrospective analysis on over 20000 consecutive patients[J].Gynecol Oncol,2018,148( 2) :254-257.
[3] Osborne RJ,Filiaci VL,Schink JC,et al. Second curettage for low-risk nonmetastatic gestational trophoblastic neoplasia[J]. Obstet Gynecol,2016,128(3):535-542.
[4] Huang M,Pinto A,Castillo RP,et al. Complete serologic response to pembrolizumab in a woman with chemoresistant metastatic choriocarcinoma [J]. J Clin Oncol,2017,35(27):3172-3174.
[5] Ghorani E,Kaur B,Fisher RA,et al. Pembrolizumab is effective for drug-resistant gestational trophoblastic neoplasia [J]. Lancet,2017,390(10110):2343-2345.
[6] You B,Bolze PA,Lotz JP,et al. Avelumab in patients with gestational trophoblastic tumors with resistance to single-agent chemotherapy:cohort a of the TROPHIMMUN phase II trial [J]. J Clin Oncol,2020,38(27):3129-3137.
[7] Cheng HY,Zong LJ,Kong YJ,et al.Camrelizumab plus apatinib in patients with high-risk chemorefractory or relapsed gestational trophoblastic neoplasia (CAP 01):a single-arm,open-label,phase 2 trial [J]. Lancet Oncol,2021,22(11):1609-1617.
[8] Gadducci A,Lanfredini N,Cosio S. Reproductive outcomes after hydatidiform mole and gestational trophoblastic neoplasia[J]. Gynecol Endo,2015,31(9):673-678.

