本文刊登于《中国实用妇科与产科杂志》2023,39(1):58-67
DOI:10.19538/j.fk2023010116
近日,美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)公布了《2023 NCCN卵巢癌包括输卵管癌及原发性腹膜癌临床实践指南(第1版)》。新版指南在卵巢癌化疗、靶向治疗、基因检测等方面有重要更新。现对新版指南进行简要解读。
1. 2023年指南主要更新
(1)新增推荐保留生育功能患者术前进行生殖内分泌与不孕症评估、必要时行子宫内膜活检。(2)一线PARP抑制剂维持治疗更新:①一线维持治疗新增卢卡帕利;②贝伐珠单抗+奥拉帕利维持治疗改为1类推荐;③BRCA突变、化疗联合贝伐珠单抗患者,停化疗后推荐奥拉帕利+贝伐珠单抗(1类)维持治疗,也可以使用PARP抑制剂单药维持治疗;④化疗联合贝伐珠单抗的同源重组修复缺陷(HRD)患者,也可以选择贝伐珠单抗维持治疗。(3)铂敏感复发PARP抑制剂维持治疗推荐更新:无论BRCA状态如何,均可使用奥拉帕利,首选用于BRCA突变患者;尼拉帕利仅限于胚系BRCA突变的患者;卢卡帕利仅限于BRCA突变的患者;使用PARP抑制剂维持时间超过24个月时应谨慎。(4)对于复发的患者,分子检测项目新增MMR、叶酸受体-a(FR-a)、RET、BRAF等。不能获得组织者推荐循环肿瘤DNA(ctDNA或液体活检)检测。(5)全身治疗方案更新:①ⅠC~Ⅳ期的低级别浆液性和G1级子宫内膜样癌,其他推荐方案中卡铂+脂质体多柔比星,多烯紫杉醇/卡铂两个化疗方案也增加了来曲唑或其他内分泌维持治疗的选择;②Ⅱ~Ⅳ期上皮性卵巢癌其他推荐方案增加多烯紫杉醇+卡铂/贝伐珠单抗+贝伐珠单抗维持治疗(GOG-218);③铂耐药复发其他推荐方案新增含铂方案,但脚注说明不用于铂难治疾病。新增伊沙匹隆/贝伐珠单抗方案。(6)铂敏感复发某些情况有效方案新增:BRAF V600E阳性肿瘤,可使用达拉非尼+曲美替尼;RET基因融合阳性肿瘤可使用塞尔帕替尼。(7)铂耐药复发首选方案新增:FR-a阳性肿瘤可使用Mirvetuximab Soravtansine。(8)铂耐药复发某些情况有效方案新增:BRAF V600E阳性肿瘤可使用达拉非尼+曲美替尼;RET基因融合阳性肿瘤可使用塞尔帕替尼;FR-a阳性肿瘤可使用Mirvetuximab Soravtansine+贝伐珠单抗。
2. 上皮性卵巢癌/输卵管癌/原发性腹膜癌手术原则
2.1 总原则 (1)推荐由妇科肿瘤医生完成手术。(2)绝大多数卵巢癌患者选择开腹手术,下腹正中直切口可用于全面分期手术、初始和间歇性减瘤术或再次减瘤术。(3)微创手术应由有经验的医生施行,可考虑用于经选择的早期疾病、评估初治和复发患者能否达到满意减瘤术、经选择的间歇性减瘤术,减瘤术不理想者须及时中转开腹。(4)术中冰冻病理检查有助于选择手术方案。(5)如考虑腹腔化疗,建议放置腹腔输液港。
2.2 手术记录 手术记录必须描述以下内容:(1)减瘤术前盆腔、中腹部、上腹部原发疾病的范围。(2)减瘤术后残留病灶的数量。(3)完整或不完整切除,如果为不完整切除,记录病灶的大小和数目。注明是粟粒状病灶还是小病灶。
2.3 初治局限于卵巢或盆腔(评估为ⅠA~ⅡA期)的浸润性上皮性卵巢癌手术步骤 尽最大努力切除盆腔所有肿瘤组织并评估上腹部或腹膜后的隐匿性病灶。(1)进入腹腔后,抽吸腹水或腹腔冲洗液行细胞学检查。(2)对腹膜表面进行全面诊视,可能潜在转移的腹膜组织或粘连组织都要切除或病理活检;如果无可疑病灶,则行腹膜随机活检并至少包括双侧盆腔、双侧结肠旁沟、膈下(也可使用细胞刮片进行膈下细胞学取样和病理学检查)。(3)切除子宫和双附件,尽力完整切除肿瘤并避免肿瘤破裂。(4)期望并符合保留生育功能指征的患者,可考虑行单侧附件切除术或切除双侧附件保留子宫。(5)切除大网膜。(6)系统切除下腔静脉和腹主动脉表面及两侧的主动脉旁淋巴结,上界至少达到肠系膜下动脉水平,最好达到肾血管水平。(7)切除盆腔淋巴结时最好包括髂内、髂外、髂总血管表面和内侧淋巴结以及闭孔神经上方的淋巴结。(8)术中冰冻确认的黏液性癌,如无可疑增大的淋巴结,可考虑不切除淋巴结。
2.4 初治累及盆腔和上腹部(评估≥ⅡB期)浸润性上皮性卵巢癌手术步骤(PDS) 尽最大努力切除所有盆腔、腹部和腹膜后肿瘤病灶。满意减瘤术标准为残余肿瘤病灶直径<1cm,尽量达到无肉眼残留病灶。(1)取腹水进行细胞学检查。(2)切除肿瘤累及的所有大网膜。(3)切除能够切除的术前影像学或术中探查发现的肿大或者可疑淋巴结;临床阴性淋巴结不需要切除。(4)为达到满意的减瘤术,可根据需要切除肠管、阑尾、脾脏、胆囊、部分肝脏、部分胃、部分膀胱、胰尾、输尿管及剥除膈肌和其他腹膜。(5)减瘤术后残余小病灶的上皮性卵巢癌或腹膜癌患者是腹腔化疗的适应证,可以考虑在初次手术时放置腹腔化疗输液港。
2.5 侵袭性上皮性卵巢癌新辅助化疗后减瘤术(IDS) 间歇性减瘤术也须尽最大努力达到最大的减瘤效果,尽力切除腹部、盆腔和腹膜肉眼可见病灶。(1)对化疗反应良好或者疾病稳定者,新辅助化疗3~4个疗程后可行间歇性减瘤术。手术时机并没有前瞻性证据,可根据患者个体化因素而定。(2)Ⅲ期患者接受间歇性减瘤术后可以考虑使用顺铂(100mg/m2)腹腔热灌注化疗;在腹腔热灌注开始时使用硫代硫酸钠持续静脉滴注以保护肾功能。(3)探查所有腹膜表面,任何可疑潜在转移的腹膜表面或粘连都必须选择性地切除或活检。(4)切除大网膜。(5)切除可以切除的可疑和(或)增大的淋巴结。初次诊断时疑有潜在转移可能的淋巴结也必须切除,即使术中探查无可疑或增大。(6)为达满意的减瘤术,可根据需要切除肠管、阑尾、剥除膈肌、其他腹膜、脾脏、胆囊、部分肝脏、部分胃、部分膀胱、胰尾、输尿管和(或)远端胰腺。
2.6 针对BRCA突变的遗传性乳腺癌-卵巢癌综合征(HBOC)患者的降低患卵巢癌风险的附件切除术方案 无更新,参见本刊2019年第35卷第5期“《2019 NCCN卵巢癌包括输卵管癌及原发性腹膜癌临床实践指南》解读”。
2.7 特殊情况
2.7.1 保留生育功能手术 希望保留生育功能的早期患者或者低风险恶性肿瘤(早期上皮性卵巢癌、低度恶性潜能肿瘤、生殖细胞肿瘤或恶性性索间质细胞瘤)可行保留生育功能手术,即行单侧附件切除术或双侧附件切除术保留子宫。有保留生育功能指征建议转诊至生殖内分泌专家进行咨询评估。需进行全面的手术分期以排除更晚期疾病。儿童/青少年/年轻成人(≤25岁)、临床明确的早期生殖细胞肿瘤可以不切除淋巴结。
2.7.2 黏液性肿瘤 原发卵巢浸润性黏液性肿瘤并不常见。必须对上下消化道进行全面评估以排除消化道转移癌。怀疑或确诊黏液性癌的患者需切除外观异常的阑尾。外观正常阑尾不须切除。术中冰冻确诊者,如无可疑或增大的淋巴结,可以不切除淋巴结。
2.7.3 卵巢交界性肿瘤(LMP) 淋巴结切除术可能提高分期,但并不影响总体生存率。大网膜切除和腹膜多点活检可使近30%患者提高分期并可能影响预后。
2.7.4 复发患者二次减瘤术 初次化疗结束后>6个月、一般情况良好、无腹水、病灶孤立可以完整切除者,可考虑二次减瘤术。可以使用有效的评分方法评估是否进行二次减瘤术。除了通过影像学,也可以采用腹腔镜评估能否完整切除病灶。二次减瘤术可选择开腹或微创方式进行。
2.7.5 辅助性姑息手术 对接受姑息治疗的晚期卵巢癌患者,如有可能需要行以下辅助性手术:腹腔穿刺术/留置腹膜透析导管、胸腔穿刺术/胸膜融合术/胸腔镜下留置胸腔导管、放置输尿管支架/肾造瘘术、胃造瘘术/放置肠道支架/手术缓解肠梗阻。
3. 病理诊断原则
肿瘤分子检测更新:(1)首诊(up-front setting)时,体细胞检测至少包含可以提供明确有效干预措施的项目,包括 BRCA1/2、杂合性丢失(LOH) 或无胚系BRCA突变的同源重组修复状态。(2)复发时,至少检测以前未检测的对肿瘤特异性或泛癌靶向治疗存在潜在获益的项目,包括但不限于:BRCA1/2、HR状态、微卫星不稳定性(MSI)、肿瘤突变负荷(TMB)、MMR、FR-a、RET、BRAF和NTRK。更全面的检测对缺少有效治疗措施的少见的病理组织类型尤为重要。(3)分子检测最好采用最新获得的组织标本或血液标本。(4)如不能获得组织进行检测,推荐进行循环肿瘤DNA(ctDNA或液体活检)检测。(5)分子检测应在经过美国临床实验室改进修正方案(CLIA)批准验证的机构进行。传统病理学推荐内容见本刊2019年第35卷第5期“《2019 NCCN卵巢癌包括输卵管癌及原发性腹膜癌临床实践指南》解读”。
4. 全身治疗原则
化疗总原则、初治、新辅助化疗和复发化疗原则无更新,见本刊2021年第37卷第4期“《2021 NCCN卵巢癌包括输卵管癌及原发性腹膜癌临床实践指南(第1版)》解读”。
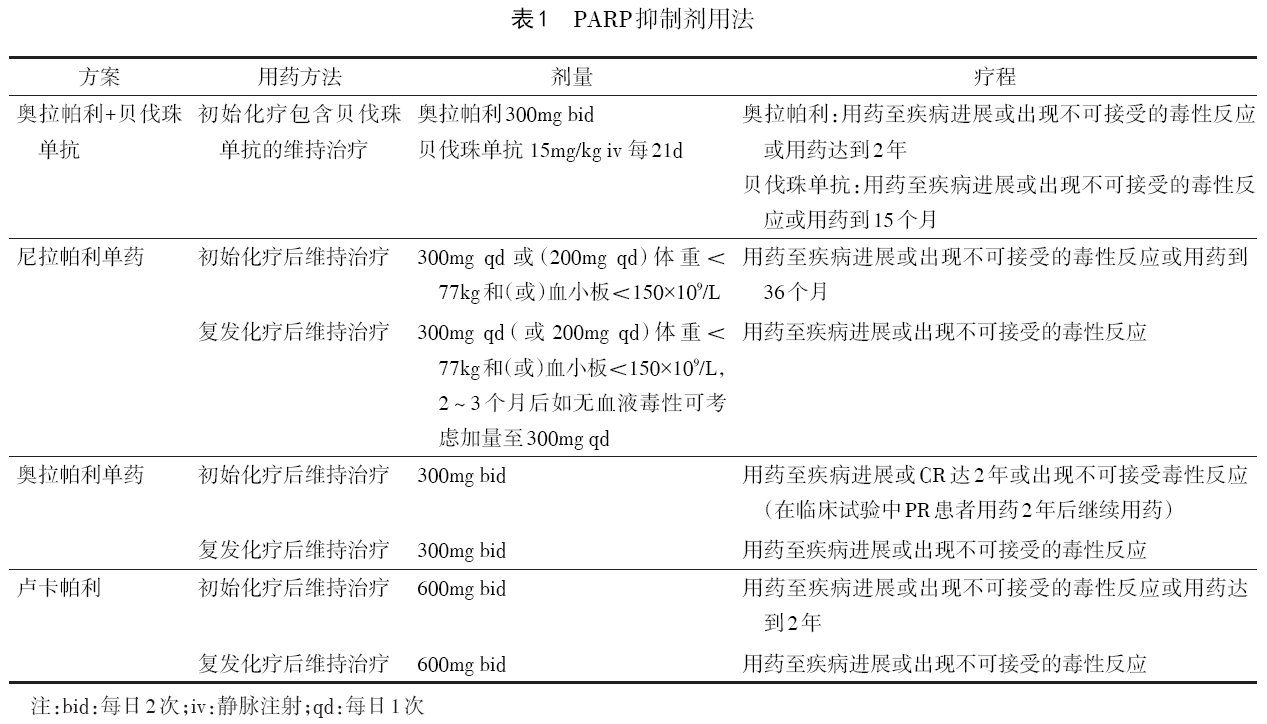
4.1 PARP抑制剂维持治疗原则
4.1.1 初始治疗后维持治疗 部分新诊断的Ⅱ~Ⅳ期高级别浆液性癌、G2/3级子宫内膜样癌,或BRCA1/2突变的透明细胞癌和癌肉瘤在手术和以铂为基础的一线治疗后达到完全缓解(CR)或部分缓解(PR),接受PARP抑制剂维持治疗可能获益。Ⅱ期患者和少见病理类型患者初始治疗后使用PARP抑制剂维持治疗的数据有限。
4.1.2 复发治疗后维持治疗 部分复发患者既往未用过PARP抑制剂,经过以铂为基础的化疗达到CR和PR后,使用PARP抑制剂维持治疗可能获益。
4.2 PARP抑制剂使用的注意事项 必须严密监测血常规、肾功能和肝功能。
使用尼拉帕利必须监测血压,使用其他PARP抑制剂也推荐监测血压。必须根据毒性反应调整合适的剂量。使用前请认真阅读使用说明书。PARP抑制剂用法见表1。
5. 化疗方案
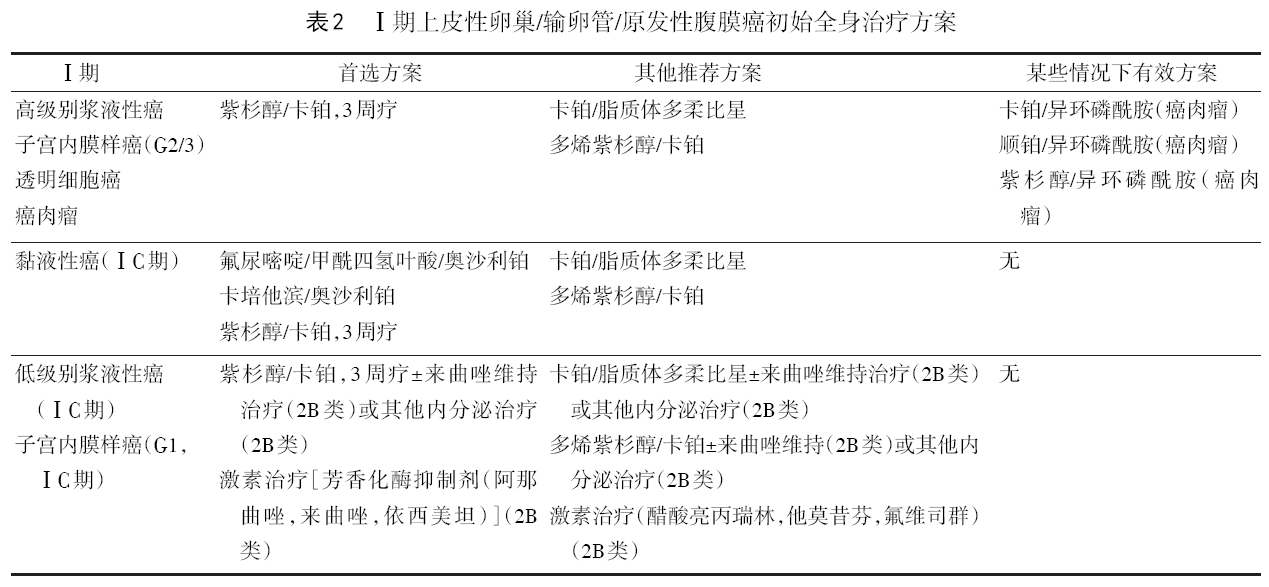
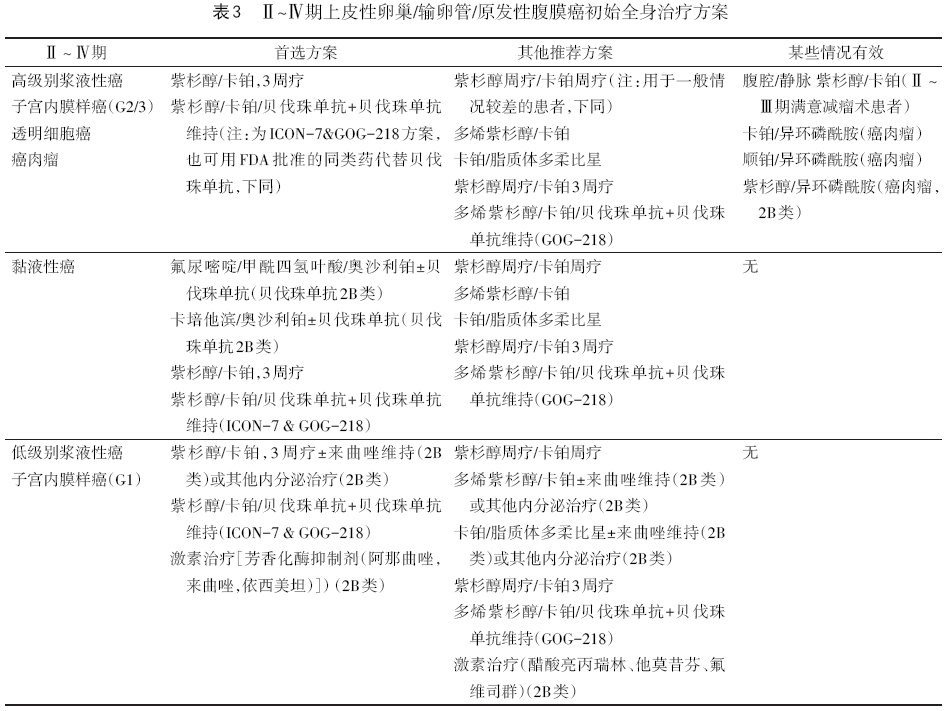
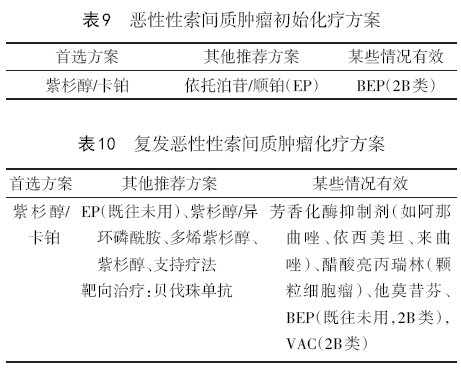
化疗方案有调整,见表2~10。





6. 药物反应的处理
化疗药物反应是常见的,有时甚至是致命的,医生必须详细了解化疗药物反应的临床表现,熟悉化疗反应的处理方法。指南详细介绍了化疗药物反应的处理,包括概述、输液反应和过敏反应三部分,有兴趣者可阅读原文。
7. 分期
新版指南根据美国癌症联合委员会(AJCC)癌症分期指南第8版,TMN分期和国际妇产科联盟(FIGO)分期。有兴趣者可阅读原文。
8. 各类型卵巢癌的处理原则
8.1 上皮性卵巢癌
8.1.1 诊断 发现盆腔可疑包块和(或)腹水、腹胀和(或)其他明显恶性相关症状的患者,在行腹部/盆腔体格检查后行超声和(或)腹部/盆腔CT、MRI或PET-CT、必要的实验室检查和肿瘤标志物测定,包括CA125、HE4、ROMA指数、CA19-9、CEA、抑制素、AFP、β-hCG和LDH。胸部影像学检查是必需检查项目。拟诊早期卵巢癌应避免细针穿刺进行诊断,以防止肿瘤破裂导致肿瘤腹腔内播散。对于晚期巨块型不适合手术患者,细针穿刺术是获得明确病理诊断的必要手段。必须排除来源于胃肠道、子宫、胰腺肿瘤和淋巴瘤。同时排除卵巢良性病变和非卵巢病变。了解家族史。
8.1.2 初始治疗 包括规范的手术分期、减瘤术,大部分患者术后需要化疗。希望保留生育功能的年轻患者,ⅠA期可行患侧附件切除+全面分期手术;ⅠB期可行双侧附件切除(保留子宫)+全面分期手术。不需保留生育功能的患者,行全子宫双附件切除+全面分期手术或减瘤术。术后进行胚系和体细胞BRCA1/2和HRD检测及相应的辅助治疗。身体状态不适合立即手术或初次减瘤术达到满意减瘤术可能性较低者,可行新辅助化疗。新辅助化疗须由妇科肿瘤专科医生确定。化疗前最好有组织学证据。若不能活检取得病理标本,则需取腹水或胸水细胞学找到癌细胞结合CA125/CEA的比值(>25)。也可以用腹腔镜评估。化疗3~4个疗程后缓解者可行IDS,手术后继续完成至少3个疗程的化疗。化疗3~4个疗程后稳定者可选择立即行IDS,也可以继续化疗至6个疗程再行IDS,术后继续化疗。
8.1.3 手术分期不全的处理 若患者接受了不全分期手术(指子宫、附件、大网膜未切除,分期记录不完整,有残留病灶),应由妇科肿瘤医生进行评估,了解家族史、进行基因检测、复习影像学资料、手术记录和病理及完善相关检查(见“诊断”)。没有残留肿瘤证据者考虑完成全面分期手术,术后根据分期、病理类型和组织分级确定是否化疗。疑有残留病灶且可以切除者行减瘤术。疑有残留病灶但无法切除者,可新辅助化疗后再行IDS。
8.1.4 术后辅助治疗 除了ⅠA和ⅠB期黏液性癌、低级别浆液性癌和G1子宫内膜样癌不需化疗,ⅠA~ⅠC1期透明细胞癌、ⅠC期黏液性癌、ⅠC期低级别浆液性癌和G1子宫内膜样癌可选择化疗或观察外,其他患者术后均需接受化疗。Ⅰ期高级别浆液癌推荐6个疗程化疗,Ⅰ期其他组织类型推荐3~6个疗程化疗。Ⅱ~Ⅳ期推荐6个疗程化疗。一般状态差、有内科合并症、>70岁患者可以选择紫杉醇(60mg/m2)/卡铂(AUC2)周疗方案。
8.1.5 初始治疗后维持治疗 一线维持治疗适用于Ⅱ~Ⅳ期治疗后CR/PR的患者,但用于Ⅱ期患者数据有限。需根据化疗是否联合贝伐珠单抗和患者的基因状态而定。主要维持治疗药物是PARP抑制剂和贝伐珠单抗。见表11。
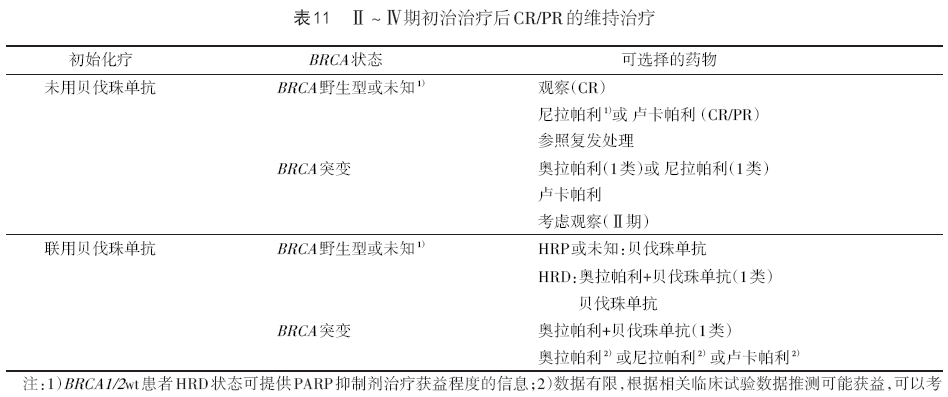
8.1.6 随访 初始治疗后前2年每2~4个月、第3~5年每3~6个月随访1次,5年后每年随访1次。随访内容包括盆腔检查、肿瘤标志物及完善基因检测。对于初始治疗没有化疗的患者,不论是CA125升高或临床复发,均按初治患者处理。若初始治疗接受过化疗,目前为临床复发,按持续性或复发性疾病处理;若仅为CA125升高,可选择推迟到临床复发再治疗或立即按复发疾病治疗(2B类)或参加临床试验。从CA125升高到出现临床复发征象的中位时间是2~6个月,现有的数据显示生化复发后立即进行治疗并无生存获益,他莫昔芬、其他激素类药物都可作为推迟治疗期间可接受的治疗方式(2B类)。
8.1.7 持续性或复发性疾病的治疗 (1)初始治疗或维持治疗后进展、或持续性或稳定性疾病、或完全缓解停化疗<6个月复发:可选择参加临床试验、支持治疗或按铂耐药复发治疗。(2)完全缓解停化疗≥6个月复发:影像学和(或)临床复发者,选择合适的病例考虑二次减瘤术。术后首选以铂为基础的联合化疗(1类)、或参加临床试验、或按复发治疗和(或)支持治疗。生化复发的处理见上文8.1.6部分。专家组认为贝伐珠单抗是复发病人的首选(特别是合并腹水者),在铂敏感或铂耐药的患者中都有效。贝伐珠单抗单药的反应率为20%,不良反应有高血压、动脉血栓形成和肠穿孔,禁用于有胃肠穿孔高风险的患者。另外,对于复发患者也可考虑姑息性局部放疗。持续性或复发性疾病治疗后,可选择参加临床试验或维持治疗(CR/PR者)或观察。对于MSI-H或dMMR或TMB≥10突变/百万碱基,可以考虑使用免疫治疗(帕姆单抗)。BRAF V600E阳性肿瘤可使用达拉非尼+曲美替尼;RET基因融合阳性肿瘤可使用塞尔帕替尼;FR-α阳性肿瘤可使用Mirvetuximab Soravtansine+贝伐珠单抗。
8.1.8 复发缓解后的维持治疗 复发治疗后缓解者,化疗联合贝伐珠单抗者停化疗后可继续使用贝伐珠单抗进行维持治疗,如果使用PARP抑制剂维持治疗,可以在使用PARP抑制剂前停用贝伐珠单抗。对于铂敏感复发完成≥二线含铂化疗、特别是有BRCA突变者,以前没用过PARP抑制剂者可使用尼拉帕利、奥拉帕利、卢卡帕利维持治疗。奥拉帕利无论BRCA状态如何均可使用,首选用于BRCA突变患者;尼拉帕利仅限于胚系BRCA突变的患者;卢卡帕利仅限于BRCA突变的患者;使用PARP抑制剂维持时间超过24个月时应谨慎。以前用过PARP抑制剂或复发后用过贝伐珠单抗者再使用PARP抑制剂的资料有限,这些患者复发治疗后的维持治疗不推荐PARP抑制剂联合贝伐珠单抗。
8.2 少见卵巢病理类型(LCOH)卵巢恶性肿瘤 少见的病理类型包括:癌肉瘤(MMMT)、透明细胞癌、黏液性癌、G1子宫内膜样癌、低级别浆液性癌、交界性上皮性肿瘤(低度恶性潜能LMP)、恶性性索-间质肿瘤和恶性生殖细胞肿瘤。由于病例数少,治疗方法不成熟,开展临床试验非常重要。可考虑进行肿瘤分子检测,可能有助于指导治疗。
8.2.1 癌肉瘤 预后很差,不适合保留生育功能。全面手术分期后所有患者术后必须接受化疗。首选紫杉醇/卡铂静脉化疗,或者用其他上皮性卵巢癌化疗方案。初始治疗后达到CR或PR者,如有BRCA1/2突变,可以考虑使用PARP抑制剂维持治疗。治疗后的监测和随访与上皮性卵巢癌相同。
8.2.2 透明细胞癌 透明细胞癌被认为是高级别肿瘤,多数透明细胞癌WT-1和雌激素受体阴性。初始治疗包括全面的手术分期加术后化疗。ⅠA~ⅠC1期术后可选择以铂为基础的静脉化疗或观察。ⅠC2~ⅠC3期选择以铂为基础的静脉化疗。Ⅱ~Ⅳ期全身系统性治疗。初始治疗后达到CR或PR并合并BRCA1/2突变者,可以考虑使用PARP抑制剂维持治疗。
8.2.3 黏液性癌 通常能早期诊断而且预后良好。5年生存率约80%~90%。黏液性癌好发于20~40岁,肿瘤体积通常很大,可以占满整个盆腹腔。PAX8免疫组化染色对鉴别卵巢原发或转移性黏液性癌可能有帮助。Ⅰ期黏液性癌可以保留生育功能。初始治疗包括全面手术分期和术后治疗,术中冰冻确诊者,如无可疑或增大的淋巴结,可以不切除淋巴结。阑尾外观有异常需切除。ⅠA~ⅠB期术后可观察,ⅠC期术后可选择观察或化疗,Ⅱ~Ⅳ期术后需全身系统性治疗。
8.2.4 G1卵巢子宫内膜样癌 卵巢子宫内膜样癌可能与子宫内膜异位症有关,免疫染色CK7、PAX8、CA125和雌激素受体阳性,其外观与性索间质细胞瘤十分相似。ⅠA~ⅠB期术后可观察。ⅠC期可选择观察(2B类)或化疗或激素治疗(2B类)。Ⅱ~Ⅳ期术后可以选择化疗或激素治疗(2B类)。ⅠC~Ⅳ期选化疗患者,化疗后可观察或来曲唑或其他激素维持治疗(2B类)。
8.2.5 低级别浆液性癌 好发于年轻患者,通常表现为晚期疾病,但是侵袭性不强,免疫染色WT-1和雌激素受体阳性。因为对化疗不敏感,不适合行新辅助化疗。初始治疗包括全面分期手术,术后处理和G1卵巢子宫内膜样癌相同。ⅠC期选择化疗的患者,化疗后可观察或来曲唑或其他激素维持治疗(2B类)。Ⅱ~Ⅳ期选择化疗的患者,化疗结束后推荐来曲唑或其他激素维持治疗。低级别浆液性癌治疗后监测和继续治疗的流程,包括治疗后监测:(1)首2年每2~4个月随访1次,第3~5年每3~6个月随访1次,5年后每年随访1次;体格检查包括盆腔检查;既往未行分子检测的行肿瘤分子检测;有临床指征行影像学检查;有指征行全血细胞分析以及生化指标检测;定期复查CA125或初发时升高的肿瘤标志物;之前未做遗传风险评估者补做遗传风险评估;长期健康护理。(2)复发后治疗:可选择参与临床试验,或曲美替尼、比美替尼(binimetinib)(2B类)、激素治疗,未化疗的患者可化疗,或参照上皮癌铂敏感、铂耐药复发推荐处理。
8.2.6 交界性上皮性卵巢肿瘤(LMP) 交界性肿瘤对化疗不敏感。完全切除肿瘤无浸润性种植者,术后可观察。有浸润性种植者,按低级别浆液癌治疗。不全分期手术者,后续治疗需结合有无残留病灶。无残留病灶者可观察。疑有残留病灶者,再次手术切除子宫和对侧附件和残留病灶;有生育要求者,行保留生育功能的手术和切除残留病灶,生育后再切除子宫和对侧附件;残留病灶不能切除或身体条件不适合手术,则直接按低级别和高级别浆液性癌的辅助治疗。出现临床复发时,合适者可行手术探查和减瘤术。术后病理无浸润性种植者仍可随访。浸润性种植或低级别浆液性上皮性卵巢癌按低级别上皮癌处理,高级别浸润性种植者按上皮性卵巢癌处理。
8.2.7 恶性性索间质瘤 卵巢恶性间质肿瘤很少见,包括粒层细胞瘤(最常见)、粒层卵泡膜细胞瘤和支持-间质细胞瘤。诊断时多处于早期,预后较好。希望保留生育功能、肿瘤局限于卵巢者可行保留生育功能的全面分期手术(可不切除淋巴结),术后可用超声随访监测,完成生育后考虑接受根治性手术(2B类)。其他所有患者建议行全面分期手术(可不切除淋巴结)。Ⅰ期低危患者术后可观察。Ⅰ期高危(肿瘤破裂、ⅠC期、分化差)或Ⅰ期中危(有异源成分)可选择观察或以铂为基础的化疗(均为2B类)。Ⅱ~Ⅳ期患者可选择以铂为基础的化疗,或对局限性病灶进行放射治疗(均为2B类)。化疗首选紫杉醇+卡铂方案,或EP(VP-16/顺铂)、BEP(2B类)。粒层细胞瘤可发生晚期复发(如30年后发生复发),建议延长这些患者的随访时间。治疗前抑制素(inhibin)升高的患者,随访时必须监测抑制素水平(2B类)。发生临床复发可选择参加临床试验、或考虑再次减瘤术、或按照复发方案进行治疗,也可考虑姑息性局部放疗。
8.2.8 恶性生殖细胞肿瘤 包括无性细胞瘤、未成熟畸胎瘤、胚胎瘤和卵黄囊瘤(内胚窦瘤)。好发于年轻女性,确诊的中位年龄是16~20岁,诊断时多为Ⅰ期。预后较好。接受规范化治疗后,5年生存率>85%。发现盆腔肿物的患者,若年龄<35岁需要检测AFP。如果考虑使用博来霉素,恶性生殖细胞肿瘤患者接受的辅助检查中应包括肺功能检测。有生育要求者,子宫和对侧附件正常者可行保留生育功能的全面分期手术,术后可用超声随访监测,完成生育后可考虑接受根治性手术(2B类)。无生育要求者行全面分期手术。儿童、青少年和年轻成人([≤]25岁)患者的手术范围与成人不同,早期患者不需切除淋巴结、大网膜仅需活检。不全分期手术者,行影像学检查和肿瘤标志物检查后分别处理:(1)无性细胞瘤或G1未成熟畸胎瘤:影像学和肿瘤标志物均阳性,希望保留生育者行保留生育功能的全面分期手术,不希望保留生育者行全面分期手术;影像学阴性、肿瘤标志物阳性,可考虑密切观察至肿瘤标志物正常(2B类);影像学和肿瘤标志物均阴性,考虑观察(2B类)。(2)胚胎癌、卵黄囊瘤、G2~3未成熟畸胎瘤、非妊娠性绒毛膜癌或混合组织类型癌:影像学和肿瘤标志物均阳性,希望保留生育者行保留生育功能的全面分期手术,不希望保留生育者行全面分期手术或减瘤术或直接化疗;影像学阴性、肿瘤标志物阳性或阴性者,按下述辅助治疗。Ⅰ期的无性细胞瘤、Ⅰ期G1未成熟畸胎瘤术后可随访。儿童和青少年ⅠA期和ⅠB期无性细胞瘤、ⅠA期G1未成熟畸胎瘤、ⅠA期胚胎癌和ⅠA期卵黄囊瘤可选择化疗或观察。任何期别的胚胎癌和卵黄囊瘤、Ⅱ~Ⅳ期的无性细胞瘤、Ⅰ期G2~3级和Ⅱ~Ⅳ期未成熟畸胎瘤、任何期别的非妊娠性绒毛膜癌术后均需化疗:(1)化疗后CR者观察。(2)影像学有残留病灶、肿瘤标志物阴性:考虑手术切除或观察,切除组织为坏死组织可观察、为良性畸胎瘤可随访、为恶性组织可补充2个疗程以铂为基础的化疗。(3)有明确的残留病灶、肿瘤标志物持续阳性:TIP方案或大剂量化疗加造血干细胞移植,建议患者转诊到三级医疗中心接受有可能治愈的治疗。治疗后随访可参照上皮癌随访方式,但头2年非无性细胞瘤患者的随访间隔应缩短为2个月。
9. 讨论
新版指南更新主要包括以下几个方面。
9.1 PARP抑制剂应用更新 PARP抑制剂一线维持治疗新增推荐卢卡帕利,主要基于2022年发表在JCO上的ATHENA-MONO/GOG-3020/ENGOT-ov45)研究。该研究结果与尼拉帕利的PRIMA研究结果类似,全人群PFS获益,但HRD患者获益大,HRD阴性患者获益小一些。PAOLA-1研究是一项评估奥拉帕利+贝伐珠单抗用于一线维持治疗的研究,其OS数据在去年欧洲肿瘤内科学会(ESMO)大会上披露,在BRCA突变和HRD阳性人群,奥拉帕利+贝伐珠单抗组中位OS显著获益,新版指南将初始治疗联用贝伐珠单抗的HRD患者使用奥拉帕利+贝伐珠单抗维持治疗推荐等级改为1类推荐。
BRCA突变人群是PARP抑制剂的最大收益者,强烈推荐晚期卵巢癌患者将PARP 抑制剂用于一线维持治疗。这些患者中可能存在高复发风险因素,而在化疗中加入了贝伐珠单抗。按照去年指南的推荐,这些患者停化疗后推荐继续使用贝伐珠单抗维持治疗,在此基础上加上奥拉帕利进行双药维持治疗。但是,这些患者本身就对PARP抑制剂单药维持治疗获益显著(比如SOLO1研究中,奥拉帕利延长PFS 42.2个月),而单用贝伐珠单抗PFS获益仅数个月(ICON7:总人群PFS无差别,高危患者延长5.5个月;GOG218:总人群PFS延长了4.1个月,Ⅳ期患者OS延长10.2个月)。对于这些患者有没有必要双药联合维持治疗是困惑广大妇瘤科医生的问题。在PAOLA-1研究中,显示双药联合优于单药,但是其获益是加上奥拉帕利后取得的效果,并非贝伐珠单抗的功效,因为两组患者均使用了贝伐珠单抗。新版指南对这个问题给出了答案,指出虽然数据有限,但根据相关临床试验数据推测单用PARP抑制剂可能获益,对于BRCA突变并在化疗中联合贝伐珠单抗的患者,停化疗后首选奥拉帕利加贝伐珠单抗维持治疗(1类推荐),但也可以考虑停贝伐珠单抗,使用PARP抑制剂单药进行维持治疗。至于哪些患者停药,哪些患者不停药,指南并未提出明确的建议,这是考验医生智慧的难题。我们的建议是:对于Ⅳ期或Ⅲ期手术未达R0、PR、经济条件许可的患者,推荐继续双药维持治疗,其他患者可考虑改PARP抑制剂单药维持治疗。
贝伐珠单抗在一线维持治疗的应用指征主要是针对BRCA野生型患者,不论HRD阳性还是阴性,在化疗联合贝伐珠单抗的患者中,新版指南均推荐可选择贝伐珠单抗单药维持治疗。当然,在HRD阳性患者中,首选还是奥拉帕利加贝伐珠单抗,因为这是1类证据。
对于既往完成二线及以上含铂化疗的铂敏感复发患者,既往指南推荐可以不考虑基因状态应用PARP抑制剂进行维持治疗。新版指南根据近来二线维持治疗的OS数据和FDA适应证的更新,对二线维持治疗的适应证进行了更新。新版指南仍然推荐对于铂敏感复发完成二线含铂化疗、特别是有BRCA突变者,以前没用过PARP抑制剂者可使用尼拉帕利、奥拉帕利、卢卡帕利维持治疗。同时也限定:无论BRCA状态如何,均可使用奥拉帕利,首选用于BRCA突变患者;尼拉帕利仅限于胚系BRCA突变的患者,卢卡帕利仅限于BRCA突变的患者。
随着各大药厂主动向FDA撤回PARP抑制剂用于后线治疗的适应证,NCCN卵巢癌指南已从2022第5版开始,将尼拉帕利、奥拉帕利和卢卡帕利的推荐等级由原来的2B类改为3类,从首选方案变为其他可选择的方案。
总之,PARP抑制剂已进入OS时代。PARP抑制剂一线维持治疗获益大于二线维持治疗,维持治疗获益又大于后线治疗。BRCA突变和HRD患者是PARP抑制剂获益的主要人群。基因检测指导精准治疗非常重要!好药早用!
9.2 基因检测推荐更新 随着靶向药物的不断研发,近年来也有很多新型靶向药物应用到卵巢癌中,并取得良好的疗效。基因检测可精准指导靶向治疗药物选择。新版指南新增推荐行FR-a、RET、BRAF等基因检测,主要是基于目前已有针对这几个基因的靶向药物应用于复发性卵巢癌的治疗中。对于不能获得组织标本进行检测,推荐进行循环肿瘤DNA(ctDNA或液体活检)检测。
9.3 靶向治疗更新 对于复发卵巢癌患者开发新型靶向治疗药物十分重要。对于铂敏感与铂耐药复发患者,新版指南新推荐了2个靶向药物方案。(1)达拉非尼+曲美替尼用于BRAF V600E阳性肿瘤。BRAF V600E突变常见于黑色素瘤和甲状腺癌,在其他类型肿瘤中较少见。指南推荐的证据来源于NCI-MATCH-EAY131-H研究。该研究主要评估选择性BRAF抑制剂达拉非尼和MEK1/2抑制剂曲美替尼在携带BRAF V600E突变的实体瘤、淋巴瘤或多发性骨髓瘤患者中的疗效。该研究纳入35例实体瘤患者,其中低级别浆液性卵巢癌5例,腹膜癌1例。患者接受达拉非尼150mg,每日2次,曲美替尼每日2mg,持续治疗直至疾病进展或出现不可耐受性毒性反应。客观缓解率(ORR)为38%,无效率为5%,PFS为11.4个月。7例患者的反应持续时间大于12个月,包括4例反应持续时间大于24个月的患者。另外8例患者PFS>6个月,中位总生存期为28.6个月。(2)塞尔帕替尼用于RET基因融合阳性肿瘤。塞尔帕替尼是首类具有CNS活性的高选择性RET激酶抑制剂,在RET阳性肺癌和甲状腺癌中疗效显著。但是其他肿瘤很少发生RET融合。指南推荐的证据来源于LIBRETTO-001研究,该研究是一个1/2期,单臂的篮子试验,主要评估塞尔帕替尼在RET基因融合阳性的晚期实体瘤(非肺癌或甲状腺癌)患者中的有效性和安全性。总共纳入了45例患者(卵巢癌1例), 41例可用于分析,客观缓解为43.9%(95%CI 28.5~60.3),主要不良反应包括高血压及肝功能异常。卵巢癌中BRAF V600E阳性和RET基因融合阳性并不多见,新版指南的用药推荐仅基于单臂的篮子试验,纳入的卵巢癌病例其实很少,并不能真实反映该方案在卵巢癌中的疗效,还有待进一步的临床试验加以验证。
针对铂耐药复发卵巢癌,新版指南在首选方案新增了Mirvetuximab Soravtansine(MIRV)用于FR-a阳性肿瘤。MIRV是一种抗体偶联药物,包含FR-a结合抗体,可切割连接剂和微管蛋白靶向剂丹素类DM4。该推荐主要源于SORAYA研究,入选2022年ASCO会议的壁报。该研究主要评估MIRV在FR-a阳性的铂耐药卵巢癌中的疗效。入组人群在前线治疗需使用过贝伐珠单抗,总共纳入106例患者,ORR为32.4%,包括5例完全缓解,常见的不良反应包括视力模糊、角膜病变和恶心。该研究显示MIRV对于FR-a高表达的铂耐药卵巢癌具有良好的疗效及可控的不良反应。
新版指南也推荐MIRV+贝伐珠单抗用于FR-a阳性肿瘤。该推荐来自FORWARDⅡ(NCT02606305)研究,该研究的第一阶段(ⅠB期)共纳入66例铂耐药的卵巢癌患者,免疫化学法检测FR-a阳性,允许先前接受贝伐珠单抗治疗,每3周给予MIRV(6mg/kg,校正体重指数)和贝伐珠单抗(15mg/kg),ORR为39%,包括5例完全缓解和21例部分缓解,中位PFS为6.9个月。在16例未接受过贝伐珠单抗治疗、既往治疗≤二线及以下、FR-a水平中的患者中尤为有效高表达(ORR:56%,中位持续缓解时间12个月;PFS:9.9个月)。2022年国际妇科癌症协会年会(IGCS)会议上,该研究进行了数据更新,在总体人群中,MIRV+贝伐珠单抗治疗的ORR为44%,有应答者,中位持续缓解时间为11.8个月,总体上,MIRV+贝伐珠单抗治疗的中位 PFS 为8.2个月。无论FR-a表达水平如何,贝伐珠单抗初治和经治患者中均观察到持久的抗肿瘤活性,且与无铂间期无关。Ⅲ期随机对照试验(GLORIOSA,GOG 3078)正在招募中,值得期待。
9.4 其他全身治疗方案更新 Ⅱ~Ⅳ期上皮性卵巢癌增加多烯紫杉醇/卡铂/贝伐珠单抗+贝伐珠单抗维持治疗。该方案并非直接来源于GOG-218研究,仅借鉴GOG-218研究中贝伐珠单抗的方案。SCOTROC研究是比较紫杉醇175mg/m2+卡铂AUC5的3周疗与多烯紫杉醇75mg/m2+卡铂AUC 5的3周疗方案的随机对照试验。总共纳入1077例ⅠC~Ⅳ期患者,随访时间为23个月,两组的PFS分别为多烯紫杉醇+卡铂组15个月,紫杉醇+卡铂组14.8个月,2 年总生存率多烯紫杉醇+卡铂组64.2%, 紫杉醇+卡铂组68.9%,均不具有统计学差异。两种方案疗效相当,多烯紫杉醇+卡铂组总体神经毒性显著降低,3~4级中性粒细胞减少及中性粒减少相关并发症增加,生活质量方面,两组无明显差异。
新版指南针对铂耐药复发化疗的另一个重要更新是在“其他推荐方案”和“可能有效方案”中新增推荐含铂化疗方案(表6)。在以往的观念中,铂耐药患者再用铂化疗疗效不佳,一般推荐非铂单药化疗。但是,在真实世界中,非铂药物疗效同样不佳。新版指南更新源于2022 ASCO会议报道的“铂类与非铂类化疗治疗铂类耐药卵巢癌:一项Meta分析”。这项荟萃分析显示,与其他非铂单药相比,针对 “铂耐药”患者的化疗,反应率最高的药物还是铂类药物,提出了“铂耐药”卵巢癌患者可能可以重新从铂类药物治疗中获得显著益处的观点。指南的更新让我们对铂耐药患者的化疗方案有了更多的选择。但需注意该推荐不适用于”铂难治“即停化疗后3个月内复发的患者。
在铂耐药复发治疗方案新增伊沙匹隆/贝伐珠单抗方案。主要证据来源于一个多中心的Ⅱ期临床研究。该研究总共纳入76例铂耐药复发卵巢癌患者,随机分组接受伊沙匹隆 20 mg/m2 治疗(第1、8、15天),联合或不联合贝伐珠单抗10 mg/kg治疗(第1、15天),每28d 1个周期。结果显示接受联合用药组(n=39)与伊沙匹隆单药组(n=37)相比,ORR为33%(n=13)vs. 8%(n=3),贝伐珠单抗显著改善PFS(中位数:5.5 vs. 2.2个月,HR=0.33,95%CI 0.19~0.55),OS(中位数:10.0 vs. 6.0个月,HR=0.52,95%CI 0.31~0.87)。该研究提示伊沙匹隆+贝伐珠单抗联合治疗铂耐药复发卵巢癌具有一定的疗效。
内分泌治疗对低级别浆液性癌和G1级卵巢子宫内膜样癌有重要意义,有效率和化疗接近。该类患者大多数不能从PARP抑制剂维持治疗中获益。近年来,指南推荐的方案已逐步演变为化疗结束后接上来曲唑等内分泌药物维持治疗,PFS显著获益。

